
 (一)甲组:实验方案:镁铝合金
(一)甲组:实验方案:镁铝合金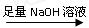 测定剩余固体质量
测定剩余固体质量 盘天平称量一定质量镁铝合金粉末
盘天平称量一定质量镁铝合金粉末 (二)乙组:实验方案:镁铝合金
(二)乙组:实验方案:镁铝合金 测定生成气体的体积
测定生成气体的体积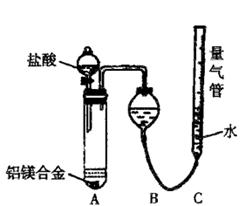

 并最终得到固体物质1.45g。则该合金中铝的质量分数为 。
并最终得到固体物质1.45g。则该合金中铝的质量分数为 。 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源:不详 题型:填空题
 的质量。
的质量。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 6CuFeS2+19O2
6CuFeS2+19O2 6CuO+2Fe3O4+12SO2
6CuO+2Fe3O4+12SO2
 气充分反应 b.除去空气中的水份
气充分反应 b.除去空气中的水份 +H2O=H2SO4+2HI,达到终点时消耗I2溶液20.00mL,判断滴定达到终点的现象为 ,通过计算,该黄铜矿的纯度为 (Cu:64 Fe:56 S:32)
+H2O=H2SO4+2HI,达到终点时消耗I2溶液20.00mL,判断滴定达到终点的现象为 ,通过计算,该黄铜矿的纯度为 (Cu:64 Fe:56 S:32)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
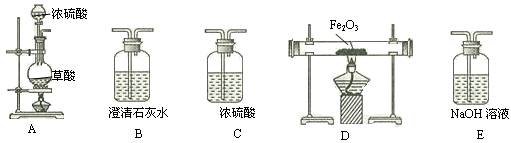
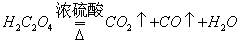 。
。
 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.直接观察焰色反应火焰为浅紫色,则一定不含Na元素 |
| B.铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色;铝热剂中一定不含Fe2O3 |
| C.溶液中滴加盐酸酸化BaCl2溶液出现白色沉淀,则溶液中一定存在SO42— |
| D.某气体能使品红溶液褪色,则该气体为SO2气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.把绿豆大的钾投入少量水中 |
| B.把一段打磨过的镁带放入少量冷水中 |
| C.把溴水加入到淀粉KI溶液中 |
| D.氢气和氯气等体积混合后强光照射 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com