
A、
| ||
B、
| ||
C、
| ||
D、
|
| n |
| V |
| (m+n)mol |
| amol/L |
| (m+n) |
| a |


科目:高中化学 来源: 题型:
| C | - 3 |
| C | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生设计一套实验装置如图所示,通过实验除去混在氮气中的氧气、二氧化碳、硫化氢和乙烯等气体,制得干燥的氮气.
某学生设计一套实验装置如图所示,通过实验除去混在氮气中的氧气、二氧化碳、硫化氢和乙烯等气体,制得干燥的氮气.| A | B | C | D | |
| 应加试剂 | ||||
| 所除杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
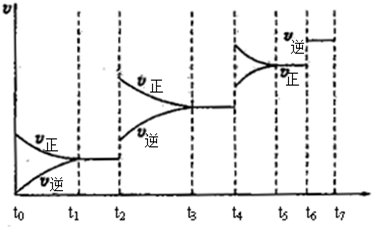
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

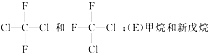
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇、乙醛和乙酸都可以与钠反应生成氢气 |
| B、蛋白质水解的最终产物是葡萄糖 |
| C、苯和乙烯都可以使溴的四氯化碳溶液反应褪色 |
| D、可用碘检验淀粉是否水解完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g),△H<0.CO和H2O浓度变化如图,下列叙述错误的是( )
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g),△H<0.CO和H2O浓度变化如图,下列叙述错误的是( )| A、0一4min的平均反应速率υ(CO2)为0.03mol/(L?min) |
| B、850℃时,平衡常数K=1 |
| C、850℃时,若向该容器中充入1.0 mol CO、1.0 molH2O,则CO的平衡转化率不变 |
| D、容器中气体密度不变不能判断该反应已经达到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com