
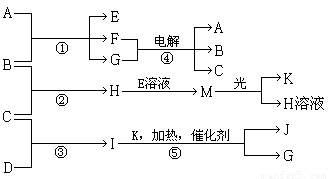
��15�֣�����A��E��F����ɫ��Ӧ�ʻ�ɫ������I��1��������4��ԭ����ɲ�������10�����ӣ�B��C��D��K�ڳ����¶������嵥�ʣ�G�ڳ���������ɫҺ�壬��Ӧ�١��ݶ������ڹ�ҵ�����ķ�Ӧ�����й�����֮������Ӧת����ϵ����ͼ��ʾ�����ַ�Ӧ��������ȥ����
��1��д�����ʵĻ�ѧʽ��B M
��2��д��A���ʵĵ���ʽ ����I�� ���ӣ���Ի�Ǽ��ԣ�
��3��0��1mol/LEˮ��Һ�и�����Ũ���ɴ�С��˳��Ϊ
��4����Ӧ�ٵ����ӷ���ʽ
��Ӧ�ݵĻ�ѧ����ʽ
��5����Ӧ���У���ת��0��02mol���Ӻ�ֹͣ��Ӧ����Һ�������200mL�����ʱ��Һ�������ǵ���������Ӧ����PH=_________��
��1��B��Cl2 M��HClO
 ����
(ע�⣺�˿�1�֣�����ÿ��2��)
����
(ע�⣺�˿�1�֣�����ÿ��2��)
��3��c��Na+����c��ClO-����c��OH-����c��H+��
��4��Cl2+2OH-=Cl-+ClO-+H2O
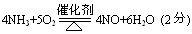
��5��13
������������I��1��������4��ԭ����ɲ�������10�����ӣ�����I�ǰ�������C��������D�ǵ�����G�ڳ���������ɫҺ�壬���G��ˮ����K��������J��NO��A��E��F����ɫ��Ӧ�ʻ�ɫ������A���������ƣ�B��������E�Ǵ������ƣ�F���Ȼ��ƣ�H���Ȼ��⣬M�Ǵ����ᡣ
��1����
��2�����������Ǻ������Ӽ��ͼ��Լ������ӻ��������ʽΪ �������������Σ������Ǽ��Է��ӡ�
�������������Σ������Ǽ��Է��ӡ�
��3������������ǿ�������Σ�ˮ���Լ��ԣ���������Ũ�ȴ�С˳����c��Na+����c��ClO-����c��OH-����c��H+����
��4������
��5�����Ե缫���ʳ��ˮ�ķ���ʽΪ2NaCl��2H2O 2NaOH��Cl2����H2����ת��0��02mol����ʱ��������������0.02mol����Ũ����0.1mol/L������pH��13��
2NaOH��Cl2����H2����ת��0��02mol����ʱ��������������0.02mol����Ũ����0.1mol/L������pH��13��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| �� |
| ||
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
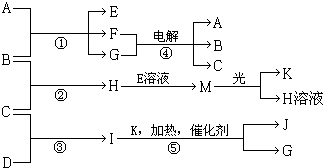 ����A��E��F����ɫ��Ӧ�ʻ�ɫ������I��1��������4��ԭ����ɲ�������10�����ӣ�B��C��D��K�ڳ����¶������嵥�ʣ�G�ڳ���������ɫҺ�壬��Ӧ�١��ݶ������ڹ�ҵ�����ķ�Ӧ�����й�����֮������Ӧת����ϵ��ͼ��ʾ�����ַ�Ӧ��������ȥ����
����A��E��F����ɫ��Ӧ�ʻ�ɫ������I��1��������4��ԭ����ɲ�������10�����ӣ�B��C��D��K�ڳ����¶������嵥�ʣ�G�ڳ���������ɫҺ�壬��Ӧ�١��ݶ������ڹ�ҵ�����ķ�Ӧ�����й�����֮������Ӧת����ϵ��ͼ��ʾ�����ַ�Ӧ��������ȥ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(13��) ����A��E��F����ɫ��Ӧ�ʻ�ɫ������I�ķ�����4��ԭ����ɲ�������10�����ӣ�B��C��D��K�ڳ����¶������嵥�ʣ�G�ڳ���������ɫҺ�壬��Ӧ�١��ݶ������ڹ�ҵ�����ķ�Ӧ�����й�����֮������Ӧת����ϵ����ͼ��ʾ��
����д���пհף�
��1��д���������ʵĻ�ѧʽ��B�� ��J��_________��
��2��д�����з�Ӧ�ķ���ʽ��
��Ӧ�ٵ����ӷ���ʽ�� ������ ��
��Ӧ�ݵĻ�ѧ����ʽ�� ��
��3����ͨ��״���£���1 g��������B������ȼ������H����ʱ�ų�92.3 k����������2 mol H������ȫ�ֽ�����C�����B������Ȼ�ѧ����ʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���ӱ�ʡ2010�������ѧ�ڵ�һ�ο��ԣ����ۣ���ѧ���� ���ͣ������
(13��) ����A��E��F����ɫ��Ӧ�ʻ�ɫ������I�ķ�����4��ԭ����ɲ�������10�����ӣ�B��C��D��K�ڳ����¶������嵥�ʣ�G�ڳ���������ɫҺ�壬��Ӧ�١��ݶ������ڹ�ҵ�����ķ�Ӧ�����й�����֮������Ӧת����ϵ����ͼ��ʾ��

����д���пհף�
��1��д���������ʵĻ�ѧʽ��B�� ��J��_________��
��2��д�����з�Ӧ�ķ���ʽ��
��Ӧ�ٵ����ӷ���ʽ�� ������ ��
��Ӧ�ݵĻ�ѧ����ʽ�� ��
��3����ͨ��״���£���1 g��������B������ȼ������H����ʱ�ų�92.3 k����������2 mol H������ȫ�ֽ�����C�����B������Ȼ�ѧ����ʽΪ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com