


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
| A、溶液和胶体的本质区别是有无丁达尔效应 |
| B、明矾在水中能形成Al(OH)3胶体,可作净水剂 |
| C、玻璃、水泥和光导纤维的主要成分都是硅酸盐 |
| D、将SO2通入品红溶液,溶液褪色后加热恢复原色,将SO2通入溴水,溴水褪色后加热也恢复原色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
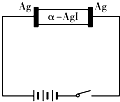 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如图所示实验.下列有关说法不正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如图所示实验.下列有关说法不正确的是( )| A、阳极反应:Ag-e-═Ag+ |
| B、阴极质量不断增大 |
| C、若α-AgI是Ag+导电,则通电一段时间后晶体质量不变 |
| D、若α-AgI是Ag+导电,则通电一段时间后晶体质量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Ca2+、F-、NO3- |
| B、K+、Ba2+、Br-、NO3- |
| C、Na+、K+、CO32-、HCO3- |
| D、Na+、Ag+、NH3?H2O、NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
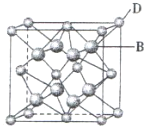 有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对电子,F原子核外电子数是B 与C核外电子数之和,D 是主族元素且与E同周期,E能形成红色或砖红色E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示.请回答下列问题:
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对电子,F原子核外电子数是B 与C核外电子数之和,D 是主族元素且与E同周期,E能形成红色或砖红色E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
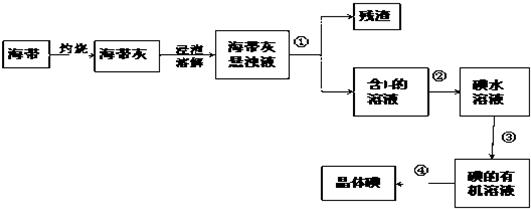
查看答案和解析>>
科目:高中化学 来源: 题型:
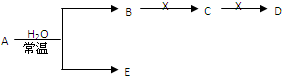
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com