
【题目】2020年4月,我国自主设计,被称为“人造太阳”的“东方超环”核聚交实验装置取得重大突破,该核聚变的基础原料是海水中提取的氘和氚。下列叙述中错误的是
A.氘原子的相对原子质量为2
B.氚原子内中子数和核外电子数之差为1
C.氘原子和氚原子互为同位素
D.海水中的H2O与D2O互为同素异形体
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 属于同分异构体
属于同分异构体
B. CH3COOCH2CH3与CHI3CH2COOCH3中均含有甲基、乙基和酯基,为同一种物质
C. C60与14C互为同素异形体
D. 乙酸与硬脂酸互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组查阅资料得知:保险粉(Na2S2O4)和KOH的混合溶液能定量吸收O2:CuCl的盐酸溶液能定量吸收CO,且易被O2氧化。拟设计实验方案,采用上述两种溶液和KOH溶液及量气装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。下列说法不正确的是

A. 采用上述3种吸收剂,气体被逐一吸收的顺序应该是CO2、O2和CO
B. 保险粉(Na2S2O4)和KOH的混合溶液吸收O2的离子方程式为2S2O42-+3O2+4OH-=4SO42-+2H2O
C. 反应结束,恢复至室温,调整水准管内液面与量气管液面齐平,可观察到量气管液面下降
D. 其他两种吸收剂不变,O2的吸收剂可以用灼热的铜网替代
查看答案和解析>>
科目:高中化学 来源: 题型:
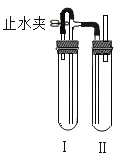
【题目】某同学用不同方法制得白色的Fe(OH)2沉淀。
(1)用未被氧化的FeSO4溶液与煮沸过的蒸馏水配制的NaOH溶液反应制备,制备过程中下列说法正确的是_______
A.用硫酸亚铁晶体配制上述FeSO4溶液时还需加入适量盐酸防止水解
B.除去蒸馏水中溶解的O2也可以采取振摇、静止的方法
C.生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液
D.FeSO4溶液上面加一层苯可以防止空气中氧气直接与溶液接触
(2)在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。在试管I 里加入稀H2SO4和铁屑,在试管II里加入NaOH溶液,打开止水夹,塞紧塞子,检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯浄时,再____(填操作步骤),这样一段时间后试管Ⅲ中制得的Fe(OH)2沉淀能较长时间保持白色,其理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质M是一种酰胺类局麻药,某研究小组以A、E两种烃为有机原料,按以下路线合成M

已知:①![]() ;②
;②![]() ;
;
③![]() 。
。
请回答:
(1)化合物G的结构简式为______。
(2)下列说法不正确的是_________。
A.A→B为氧化反应
B.化合物G能与浓盐酸反应形成盐
C.化合物H与NaOH溶液反应最多消耗2molNaOH
D.局麻药M的分子式为C14H20N2O
(3)写出D+G→H的化学方程式:____________。
(4)写出满足下列条件的化合物F的所有同分异构体的结构简式________。
ⅰ.能与FeCl3溶液发生显色反应
ⅱ.能发生银镜反应
ⅲ.苯环上只有两个取代基且苯环上只有2种不同环境的氢原子
(5)该小组成员还提出另一种合成M的方案:化合物C与二乙胺[HN(CH2CH3)2]反应制取化合物X,X与G经一步反应即可制得药物M。请设计以烃A为原料制备化合物X的合成路线___________________________(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A. 图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
B. 图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
C. 用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
D. 图4表示在N2(g)+3H2(g) ![]() 2NH3(g)达到平衡后,减小NH3浓度时速率的变化
2NH3(g)达到平衡后,减小NH3浓度时速率的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列叙述正确的是
A. 1 mol甲苯含有6NA个C-H键
B. 2 L 0.5 mol L-1硫酸钾溶液中阴离子所带电荷数为NA
C. 1 mol Na2O2固体中含离子总数为4NA
D. 丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,下列推断正确的是
选项 | I中试剂 | II中试剂及现象 | 推 断 |
A | 铁粉与湿棉花 | 肥皂水冒泡 | 铁粉与水蒸气 发生了反应 |
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成 FeO和SO2 |
C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液 褪色 | 石蜡油分解产物中 含有不饱和烃 |
D | 氯化铵 | 酚酞溶液不变红色 | 氯化铵不分解 |

A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略去)如下:

有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g/cm3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~65℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)仪器D的名称为_____。
(2)①滴加酸性Na2Cr2O7溶液时反应的离子方程式为______________;
②蒸馏不能分离环己酮和水的原因是_____。
(3)环己酮需要经过以下操作提纯:
a.往液体中加入NaCl固体至饱和,静置,分液
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.加入无水MgSO4固体,除去有机物中少量的水
d.过滤
e.蒸馏、除去乙醚后,收集151~156℃馏分
①b中水层用乙醚萃取的目的是_____;
②上述操作a、d中使用的玻璃仪器除烧杯、玻璃棒外,还需要的玻璃仪器有____、___,操作a中,加入NaCl固体的作用是_____。
(4)恢复至室温时,分离得到纯产品体积为8mL,则环己酮的产率为____。(保留3位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com