
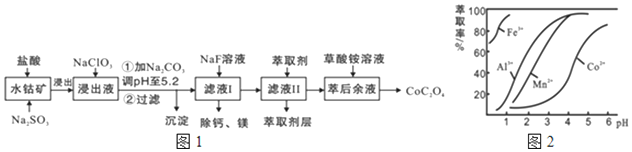
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的PH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
分析 水钴矿中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MgCl2、CaCl2、MnCl2,加入NaClO3,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MgCl2、CaCl2、MnCl2,向溶液中加入NaF溶液,除去钙镁离子,然后过滤得到的滤液中II中加入萃取剂,萃取后溶液加入草酸铵,得到草酸钴,据此分析作答.
解答 解:(1)亚硫酸钠具有还原性,能还原氧化性离子Co3+,反应为:2Co3++SO32-+H2O=2Co2++SO42-+2H+;
故答案为:2Co3++SO32-+H2O=2Co2++SO42-+2H+;
(2)NaClO3的作用是:将浸出液中Fe2+氧化为Fe3+,加Na2CO3调PH=5.2能使Fe3+、Al3+ 离子转化成氢氧化物沉淀Al(OH)3、Fe(OH)3;
故答案为:将 Fe2+氧化为 Fe3+;Al(OH)3、Fe(OH)3;
(3)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;
由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;
故答案为:除去Mn2+;B;
(4)由溶度积可知,滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为CaF2、MgF2沉淀,根据溶度积可知c(Mg2+):c(Ca2+)=$\frac{Ksp(Mg{F}_{2})}{Ksp(Ca{F}_{2})}$=$\frac{7.35×1{0}^{-11}}{1.05×1{0}^{-10}}$=0.7;
故答案为:0.7;
(5)mkg含钴废料中含Co2O3质量分数为a%,则钴元素的物质的量为$\frac{m×a%×1{0}^{-3}×2}{166}$mol,钴元素质量守恒则,草酸钴晶体(CoC2O4?2H2O)的质量为$\frac{m×a%×1{0}^{-3}×2}{166}$mol×183g/mol=$\frac{1830ma}{83}$g=16.6ma;
故答案为:$\frac{1830ma}{83}$或16.6ma.
点评 本题考查物质分离和提纯,为高频考点,涉及溶度积常数计算、沉淀与pH的关系、盐类水解、氧化还原反应等知识点,明确实验原理是解本题关键,知道涉及的操作方法及发生的反应,难点是溶度积常数计算,题目难度中等.


科目:高中化学 来源: 题型:解答题
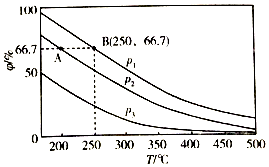 氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.
氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.| H-H | N-H | N-N | N |
| 435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 杜绝化石燃料的使用,从源头上解决问题 | |
| B. | 减少燃料燃烧产生的热量损耗的技术,提高燃料利用率的措施 | |
| C. | 防止燃料燃烧造成环境污染的方法 | |
| D. | 通过化学方法把化石燃料转化成洁净燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
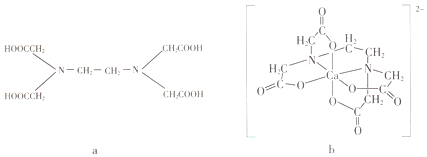 a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物.b为EDTA与Ca2+形成的螯合物.下列叙述正确的是( )
a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物.b为EDTA与Ca2+形成的螯合物.下列叙述正确的是( )| A. | b含有分子内氢键 | B. | b中Ca2+的配位数为4 | ||
| C. | b含有共价键、离子键和配位键 | D. | a和b中的N原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
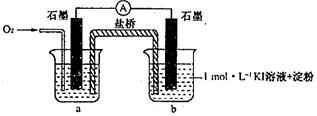
| 序号 | 烧杯中的液体 | 5分钟后现象 |
| ① | 2mL 1mol•L-1KI溶液+5滴淀粉 | 无明显变化 |
| ② | 2mL1mol•L-1KI 溶液+5 滴淀粉+2mL0.2mol•L-1HC1 | 溶液变蓝 |
| ③ | 2mLl mol•L-1KI溶液+5滴淀粉+2mL0.2mol•L-1KC1 | 无明显变化 |
| ④ | 2mL1mol•L-1KI溶液+5滴淀粉+2mL0.2mol•L-1CH3COOH | 溶液变蓝,颜色 较②浅 |
| 序号 | 烧杯中的液体 | 5小时后现象 |
| ⑤ | 2mL混有KOH的pH=8.5的lmol•L-1KI溶液+5滴淀粉 | 溶液略变蓝 |
| ⑥ | 2mL混有KOH的pH=10的lmol•L-1KI溶液+5滴淀粉 | 无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
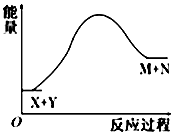
| A. | X的能量一定低于M的能量,Y的能量一定低于N的能量 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | X和Y的总能量一定低于M和N的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Mg和金属Cu的空间利用率 | |
| B. | BF3和CH4中心原子的价层电子对数 | |
| C. | 邻羟基苯甲醛(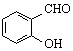 )和对羟基苯甲醛( )和对羟基苯甲醛(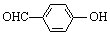 )的沸点 )的沸点 | |
| D. | C-O和Si-O的键能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com