
| A. | 正极附近的S042-离子浓度逐渐增大 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 铜片上有H2逸出 | |
| D. | 溶液的pH逐渐变小 |
分析 铜-锌-稀硫酸原电池中,活泼金属锌作负极,铜作正极;负极上锌失电子生成锌离子,正极上氢离子得电子生成氢气;溶液中阴离子向负极移动,阳离子向正极移动;根据溶液中氢离子浓度的变化判断溶液PH值的变化.
解答 解:A、该原电池放电时,溶液中阴离子向负极移动,阳离子向正极移动,所以正极附近的S042-离子浓度逐渐减小,故A错误.
B、铜-锌-稀硫酸原电池中,活泼金属锌作负极,铜作正极;原电池放电时,电子从负极锌沿导线流向正极铜,故B错误.
C、铜-锌-稀硫酸原电池中,活泼金属锌作负极,铜作正极,正极上氢离子得电子生成氢气,电极反应式为:2H++2e-=H2↑,故C正确.
D、该原电池中正极上氢离子得电子生成氢气,导致溶液中氢离子浓度降低,溶液的PH值增大,故D错误.
故选:C.
点评 本题考查了原电池原理,难度不大,易错点为:判断溶液中阴阳离子的移动方向.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$ N2H4(g)+$\frac{1}{2}$O2(g)=$\frac{1}{2}$N2(g)+H2O(l)△H=+267kJ•mol-1 | |
| B. | N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-133.5kJ•mol-1 | |
| C. | N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJ•mol-1 | |
| D. | N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极的电极反应式为 CH3OH+8OH--6e-=CO32-+6H2O | |
| B. | 正极的电极反应式为4OH-+4e-=2H2O+O2↑ | |
| C. | 标准状况下,通入5.6L O2并完全反应后,有0.50 mol电子转移 | |
| D. | 放电一段时间后,通入O2的电极附近溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5 mol | B. | 2 mol | C. | 1.25 mol | D. | 0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是用于衡量化学反应进行快慢的物理量 | |
| B. | 决定化学反应速率的主要因素是反应物本身的性质 | |
| C. | 可逆反应达到化学平衡状态时,反应停止,正、逆反应速率都为零 | |
| D. | 增大反应物浓度或升高反应温度都能加快化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
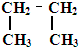
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
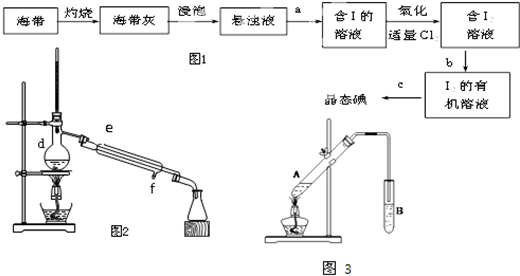
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com