
【题目】FeCl3的水解方程式可写为FeCl3+3H2O![]() Fe(OH)3+3HCl,若提高水解程度采取的方法是 ( )
Fe(OH)3+3HCl,若提高水解程度采取的方法是 ( )
A.降低温度B.加入少量Na2CO3 C.加入少量盐酸D.增加FeCl3的浓度
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】现有常温下体积均为10 mL、 pH=3的两种溶液:① HCl溶液,② CH3COOH溶液。下列说法中,正确的是
A. 溶液中溶质的物质的量浓度:① > ②
B. 溶液中酸根的物质的量浓度:① = ②
C. 加水稀释至1 L,溶液的pH:① < ②
D. 分别加入等浓度NaOH溶液至中性,消耗NaOH的量:① = ②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的操作、原理和现象,正确的是![]()
A.称取![]() 时,将10g的砝码放在右盘,并将游码移到
时,将10g的砝码放在右盘,并将游码移到![]() 的位置
的位置
B.做钠与水反应的实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象
C.向试管中加入5mL溴水、2mL苯和![]() 铁粉,充分振荡后静置,观察试管底部生成褐色油状液滴
铁粉,充分振荡后静置,观察试管底部生成褐色油状液滴
D.为验证盐桥的作用,在两个烧杯中分别盛适量硫酸亚铁铵溶液和稀酸性高锰酸钾溶液,分别插入石墨棒用导线与电流计相连,然后用装有![]() 饱和溶液的琼脂的U型管两端插入两个烧杯中,电流计偏转,一段时间后高锰酸钾溶液褪色
饱和溶液的琼脂的U型管两端插入两个烧杯中,电流计偏转,一段时间后高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含 Fe2+、Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:

回答下列问题:
(1)浸出时,为了提高浸出效率采取的措施有(写两种):__________;
(2)氧化时,加入KMnO4溶液是为了除去浸出液中的Fe2+和Mn2+(溶液中Mn元素全 部转化为MnO2),请配平下列除去Fe2+的离子方程式:
______MnO4-+______Fe2++_____=______MnO2↓+______Fe(OH)3↓+______H+
(3)加入锌粉的目的是_____________________。
(4)已知H2SO4浸出液中,c(Fe2+)=5.04mg/L、c(Mn2+) ="1." 65mg/L。
①加入KMnO4溶液反应一段时间后,溶液中c(Fe3+) ="0." 56 mg/L,若溶液pH=3,则此时Fe3+_________(填“能”或“不能”)发生沉淀。
②若要除尽1m3上述浸出液中的Fe2+和Mn2+,需加入________g KMnO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式正确的是( )
A.用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:Na2S2O3+2H+=SO2↑+S↓+2Na++H2O
B.硝酸铁溶液中加入少量碘化氢:2Fe3++2I-=2Fe2++I2
C.向NaClO溶液中通入少量CO2制取次氯酸:ClO-+H2O+CO2=HClO+HCO3-
D.硫酸铝铵与氢氧化钡以1:2混合形成的溶液:Al3++2SO42-+2Ba2++4OH-=BaSO4↓+AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应生成盐和水,向一定量的W的最高价氧化物对应的水化物溶液中逐滴加入XZ3溶液,生成的沉淀X(OH)3的质量随XZ3溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是()

A. d点对应的溶液中:K+、NH4+、CO32﹣、I﹣
B. c点对应的溶液中:Ag+、Ca2+、NO3﹣、Na+
C. b点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣
D. a点对应的溶液中:Na+、K+、SO42﹣、HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F 原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3 个能级,且毎个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子,E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)请写出D基态的价层电子排布图:_____。
(2)下列说法正确的是_____。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,结构相似,化学性质相似
D.稳定性:H2O>H2S,原因是水分子间存在氢键
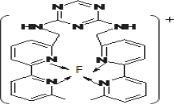
(3)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成如图所示的离子,该离子中碳原子的杂化方式是______。
(4)己知(BC)2是直线性分子,并有对称性,且分子中每个原子最外层都达到8电子稳定结构,则(BC)2中σ键和π键的个数比为______。
(5)C元素最高价含氧酸与硫酸酸性强度相近,原因是______。
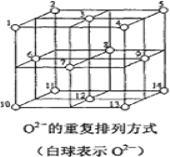
(6)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为_____,有_____%的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=______pm。(写出计算表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、 1 mol O2 | 4 mol SO3 | 2 mol SO2、 1 mol O2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 K3 |
下列说法正确的是
A.v1<v2,c2<2c1
B.K1>K3,p2>2p3
C.v1<v3,α1(SO2)>α3(SO2)
D.c2>2c3,α2(SO3)+α3(SO2)=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com