
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |

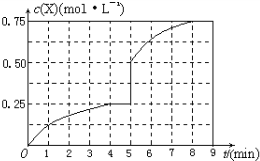
| ||
| △t |
| ||
| 4min |
| 0.5mol |
| 2L |
| (2-0.5×2)mol |
| 2L |
| (1-0.5)mol |
| 2L |
| 0.25mol/L |
| (0.5mol/L)2.(0.25mol/L) |
 ;
;

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
| A、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B、蒸馏时,温度计水银球靠近蒸馏烧瓶的底部,且冷却水从冷凝管的下口通入上口流出 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、向1 mol?L-1氯化铁溶液中加入少量的NaOH溶液制取氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 连接好并放置片刻后,铁片会镀上一层铜 |
B、 连接好导线后(片与片相接触),电流表会发生明显偏转 |
C、 连接好并放置片刻后,在Zn片附近加一滴酚酞溶液,溶液变为红色 |
D、 发生反应为Fe+2H+═Fe2++H2↑时,a、b可能是同种材料的电板 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的C02等都是雾履形成的原因.
2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的C02等都是雾履形成的原因.| 催化剂 |
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.| A-B | A═B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| Y2 | 154.8 | 418.4 | 941.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
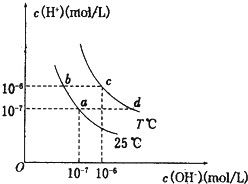 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件下关于离子存在的说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件下关于离子存在的说法中正确的是( )| A、c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Fe2+ |
| B、b点对应的溶液中大量存在:NH4+、K+、Cl-、NO3- |
| C、d点对应的溶液中大量存在:Al3+、K+、ClO-、Cl- |
| D、a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com