


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
| A、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B、实验室中用稀HNO3溶液与Cu反应制取NO气体反应很慢,加一块石墨使之与Cu接触后反应加快 |
| C、把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 一 | 二 | 三 | 四 |
| M(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| M(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
| A、实验一反应后溶液中含有Fe3+、Fe2+、Cu2+ |
| B、实验二、三反应后剩余固体全部是Cu |
| C、实验四的滤液中c(Fe2+)=1.5mol?L-1 |
| D、原粉末样品中m(Fe):m(Cu)=7:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶液中:K+、Cu2+、Na+、C1-、SO42- | ||
| B、pH=ll的溶液中:HCO3-、Na+、NH3.H2O、NO3- | ||
C、常温下,
| ||
| D、在含有大量Fe3+的溶液中:A13+、Na+、S2-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
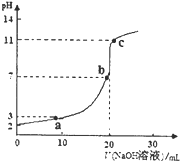 室温时,将0.10mol?L-1 NaOH溶液滴入20.00mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积变化曲线如图.下列有关说法不正确的是( )
室温时,将0.10mol?L-1 NaOH溶液滴入20.00mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积变化曲线如图.下列有关说法不正确的是( )| A、该一元酸溶液浓度为0.10mol?L-1 |
| B、a、b、c点的水溶液导电性依次增强 |
| C、室温时,HA的电离常数Ka≈1×10-5 |
| D、a点和c点所示溶液中H2O的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 三氯化铁是合成草酸铁的重要原料.
三氯化铁是合成草酸铁的重要原料.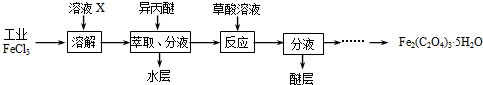
查看答案和解析>>
科目:高中化学 来源: 题型:
 所示.试回答下列问题:
所示.试回答下列问题: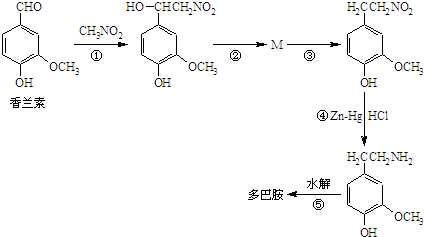
查看答案和解析>>
科目:高中化学 来源: 题型:
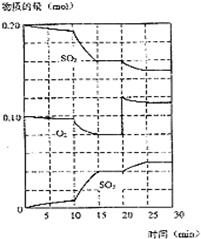 已知600℃时,在2L密闭容器中,将二氧化硫和氧气混合发生反应:
已知600℃时,在2L密闭容器中,将二氧化硫和氧气混合发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤⑥④③ |
| B、①⑤②④⑥③ |
| C、①⑤②③④⑥ |
| D、①⑥④⑤③② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com