
 金属镁及其化合物在生活、工农业生产等方面有广泛的应用.
金属镁及其化合物在生活、工农业生产等方面有广泛的应用.分析 (1)判断元素原子的核外电子数,再根据核外电子排布规律来写电子排布式;元素的金属性越强,第一电离能越小,但Mg原子由于最外层s轨道电子处于全满稳定状态;
(2)根据SO42-中心原子含有的共价键个数与孤电子对个数之和确定其空间构型和杂化方式;原子个数相等且价电子数相等的微粒为等电子体;
(3)醇分子间存在氢键,作用力较强,沸点高;CH3MgCl水解生成氢氧化镁、氯化镁和甲烷;
(4)①根据均摊法计算阴阳离子的数目;
②根据晶胞密度$ρ=\frac{m}{V}$计算.
解答 解:(1)Mg元素为12号元素,原子核外有12个电子,所以核外电子排布式为:1s22s22p63s2.
Mg原子最外层s电子全满,为稳定结构,金属性强的第一电离能小,则第一电离能由大到小的顺序为Mg>Al>Na,
故答案为:1s22s22p63s2;Mg>Al>Na;
(2)SO42-中S原子价层电子对=4+$\frac{1}{2}$(6+2-4×2)=4,且不含孤电子对,所以其立体构型是正四面体,硫原子采取sp3杂化;原子个数相等且价电子数相等的微粒为等电子体,与SO42-互为等电子体的微粒为:CCl4、PO43-、SiO44-,
故答案为:正四面体;sp3;CCl4、PO43-、SiO44-;
(3)醇分子间存在氢键,作用力较强,沸点高.CH3MgCl水解生成氢氧化镁、氯化镁和甲烷,水解方程式为:2CH3MgCl+2H2O=Mg(OH)2↓+MgCl2+2CH4↑,
故答案为:高;2CH3MgCl+2H2O=Mg(OH)2↓+MgCl2+2CH4↑;
(4)①晶胞中含有阴离子数为8,阳离子的数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,以顶点阳离子为例,在每个晶胞中均有一个阴离子,故阳离子的配位数为8.
故答案为:8;8;
②晶胞中含有阴离子数为8,阳离子的数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量m=$\frac{35.5×8+40×4}{{N}_{A}}$,晶胞体积V=a3,晶胞密度$ρ=\frac{m}{V}$=$\frac{444}{{N}_{A}•{a}^{3}}$,故a=$\frac{444}{ρ{N}_{A}}$,
故答案为:$\frac{444}{ρ{N}_{A}}$.
点评 本题主要考查了原子核外电子排布、原子轨道杂化方式及杂化类型判断、晶胞计算等知识,注意利用均摊法计算晶胞中各种原子个数,解题关键是仔细观察晶胞结构图.


科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①③⑤ | C. | ②④⑤⑥⑦ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )| A. | ①③④ | B. | ①③④⑤ | C. | ②③④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
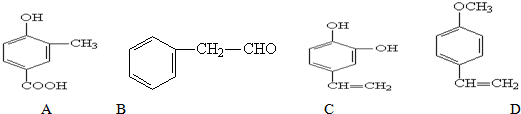
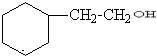 .
.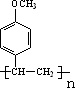 .
.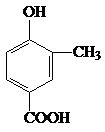 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A2B | B. | AB | C. | AB2 | D. | A2B4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ•mol-1 | B. | 2H2(g)+O2(g)+2H2O(l);△H=-484kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=+242kJ•mol-1 | D. | 2H2(g)+O2(g)=2H2O(g);△H=-484kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com