
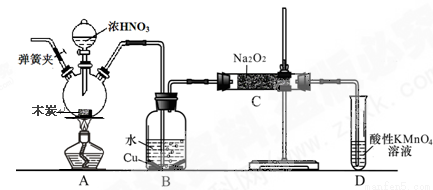
(8分)亚硝酸钠被称为工业盐,不能用作食品工业,但在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
已知:室温下,①2NO+Na2O2 = 2NaNO2
②3NaNO2+3HCl == 3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2– 都能与MnO4–反应生成NO3– 和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2)B中观察到的主要现象是有无色气体产生和 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(5)将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
(8分)(1)C+4HNO3(浓)  CO2↑+4NO2↑+2H2O(2分)
CO2↑+4NO2↑+2H2O(2分)
(2)铜片逐渐溶解,溶液变为蓝色 (1分) 吸收未反应的NO(1分)
(3)取样,加入稀盐酸,产生无色气体,遇到空气变为红棕色(1分)
(4)碱石灰 (1分)
(5)1.8g(2分)
【解析】
试题分析:(1)木炭与浓硝酸在加热条件下反应生成二氧化碳、二氧化氮、水,化学方程式为C+4HNO3(浓)  CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(2)因为二氧化氮与水反应生成硝酸,所以B中有硝酸产生,则Cu可与硝酸反应生成硝酸铜、NO、水,所以除生成气体外,还会看到Cu片不断溶解,溶液变为蓝色;因为B装置中有NO产生,与过氧化钠反应生成亚硝酸钠,所以D装置的作用是吸收未反应的NO;
(3)根据已知②3NaNO2+3HCl == 3NaCl+HNO3+2NO↑+H2O,可知检验C中是否有亚硝酸钠的方法是用盐酸来检验,具体操作为取样,加入稀盐酸,产生无色气体,遇到空气变为红棕色;
(4)因为二氧化碳、水都与过氧化钠反应生成碳酸钠、氢氧化钠,造成产品中含有杂质,所以应除去二氧化碳、水,吸收二氧化碳、水的最佳试剂是碱石灰,所以在B、C装置间增加装置,则该装置中盛放的药品名称碱石灰;
(5)7.8g过氧化钠的物质的量是0.1mol,根据已知可列Na2O2~2NO~6NO2~3/2C,所以需要木炭的质量是1.8g。
考点:考查对木炭与硝酸反应产物的检验,实验方案的设计


科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
往含等物质的量的偏铝酸钠与氢氧化钠的混合溶液中通入二氧化碳,产生沉淀的量与通入二氧化碳的量关系正确的是


查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论,正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某钠盐溶液中滴加稀硫酸 | 产生能够使石灰水变浑浊的气体 | 该溶液中一定含有CO32-或HCO3- |
B | KIO3溶液中加入HI溶液,并加入淀粉 | 溶液变蓝色 | KIO3的氧化性比I2强 |
C | 向Na2S溶液中滴加盐酸 | 产生臭鸡蛋气味的气体 | 氯的非金属性比硫强 |
D | CO还原Fe2O3得到的黑色固体加入盐酸溶解后,再加入KSCN溶液 | 溶液不显红色 | 黑色固体中无Fe3O4 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高密市高三12月检测理综化学试卷(解析版) 题型:填空题
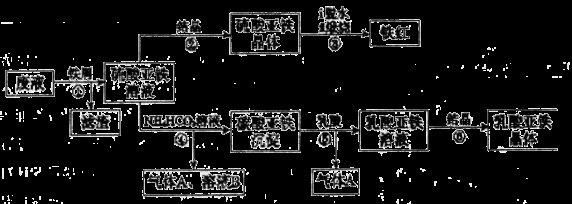
(16分)某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如下:
已知:
①TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-:
②)TiOSO4水解的反应为:TiOSO4+(x+1)H2O=TiO2?xH2O↓+H2SO4
请回答:
(1)步骤①所得滤渣的主要成分为__________________。
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比_______。
(3)步骤④需控制反应温度低于35℃,其目的是___________________。
(4)步骤④反应的离子方程式是______________________。
(5)已知:FeCO3(s)  Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。
Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。
(6)溶液B常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________________________________。
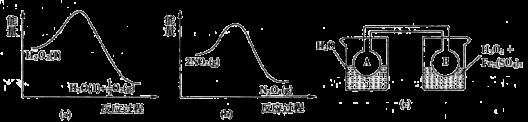
(7)Fe3+对H2O2的分解具有催化作用。利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高密市高三12月检测理综化学试卷(解析版) 题型:选择题
一元中强酸次磷酸(H3PO2)是一种精细化工产品,下列说法正确的是
A.次磷酸的电离方程式为H3PO2 3H++PO23-
3H++PO23-
B.次磷酸中P的化合价为+1
C.NaH2PO2是酸式盐
D.NaH2PO2溶液显弱酸性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高三上学期12月月考化学试卷(解析版) 题型:选择题
图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是
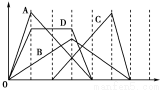
A、向NaAlO2溶液中滴入盐酸至过量
B、向澄清石灰水中通入CO2至过量
C、向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D、向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高三上学期12月月考化学试卷(解析版) 题型:选择题
将4 mol金属Al全部转化为Al(OH)3,过程中共消耗HCl a mol、NaOH b mol,则a+b最小值为
A、4 B、6 C、8 D、16
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省六校联盟高三第三次联考理科综合试卷(解析版) 题型:选择题
设nA表示阿伏加德罗常数的数值。下列说法正确的是
A.标准状况下,11.2L CHCl3含有0.5 nA个CHCl3分子
B.常温常压下,16 g O3含有8nA个电子
C.1L 0.1 mol/L醋酸溶液中含有0.1nA个氢离子
D.27g铝片投入足量浓HNO3中生成nA个NO分子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省东莞市三校高二上学期期中联考化学试卷(解析版) 题型:选择题
CO(g)与H2O(g)反应的能量变化如图所示,有关两者反应的说法正确的是
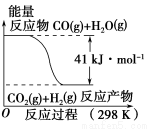
A.该反应为吸热反应
B.CO(g)和H2O(g)具有的总能量大于CO2(g)和H2(g)具有的总能量
C.该反应不需要加热就能进行
D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g) 要放出41 kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com