
分析 (1)使溶液由黄色变成蓝色,应使平衡向左移动,可以加入硝酸银溶液降低氯离子浓度;
(2)在一定温度下,在一个容积不变的有催化剂的容器中,通入2moL N2和8moL H2,设转化氮气为xmol,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):2 8 0
转化量(mol):x 3x 2x
平衡量(mol):2-x 8-3x 2x
达到平衡时容器内气体压强为起始时的80%,则10-2x=10×80%,解得x=1,据此解答.
解答 解:(1)使溶液由黄色变成蓝色,应使平衡向左移动,可以加入硝酸银溶液降低氯离子浓度,
故答案为:加入硝酸银溶液;
(2)在一定温度下,在一个容积不变的有催化剂的容器中,通入2moL N2和8moL H2,设转化氮气为xmol,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):2 8 0
转化量(mol):x 3x 2x
平衡量(mol):2-x 8-3x 2x
达到平衡时容器内气体压强为起始时的80%,则10-2x=10×80%,解得x=1,
①达到平衡时,N2的转化率为$\frac{1mol}{2mol}$×100%=50%,故答案为:50%;
②达到平衡时,容器内NH3的体积分数为$\frac{2mol}{8mol}$×100%=25%,故答案为:25%;
③参加反应的n(N2)=1mol,所以放出的热量为1mol×92.2kJ•mol-1=92.2kJ,故选:b.
点评 本题考查化学平衡计算与影响因素,难度不大,注意三段式解题法在化学平衡计算中应用.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10mol SO3和0.010mol O2,到达平衡时,n(SO2)=0.012mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.0070mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050mol SO2和0.030mol O2,达到平衡时SO2转化率大于88% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
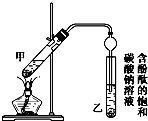 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 实验 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| ① | 2 | 2 | 1.33 |
| ② | 3 | 2 | 1.57 |
| ③ | 4 | 2 | x |
| ④ | 5 | 2 | 1.76 |
| ⑤ | 2 | 3 | 1.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用甲烷和二氧化碳可以制备化工原料.
用甲烷和二氧化碳可以制备化工原料.| 物质 | H2 | CO | CH4 | CH3COOH |
| 燃烧热(kJ/mol) | 286 | 283 | 890 | 874 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com