
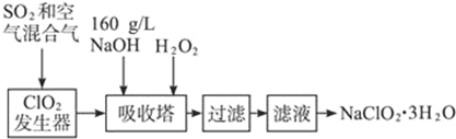
分析 ClO2在二氧化硫和Ar气混合气体中不易分解爆炸,在吸收塔中挤入氢氧化钠溶液和过氧化氢发生氧化还原反应生成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO2•3H2O,
(1)设氢氧化钠溶液的体积为VL,先根据m=ρV、n=$\frac{m}{M}$计算出氢氧化钠的物质的量,再根据c=$\frac{n}{V}$计算出NaOH溶液物质的量浓度;
(2)1gSO2完全转化时,放出akJ热量,1molSO2完全转化时,放出64akJ热量;
(3)根据题目信息并运用氧化还原反应理论判断反应物、生成物.根据流程信息可知,吸收塔内生成NaClO2,一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生;
(4)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.得到的粗晶体经过重结晶可得到纯度更高的晶体;
(5)ClO2-失电子生成ClO3-;
(6)根据方程式2NaClO3(aq)+SO2(g)=Na2SO4(aq)+2ClO2(g),H2O2+2ClO2+2NaOH=2NaClO2+O2↑+H2O计算.
解答 解:ClO2在二氧化硫和Ar气混合气体中不易分解爆炸,在吸收塔中挤入氢氧化钠溶液和过氧化氢发生氧化还原反应生成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO2•3H2O,
(1)质量分数为10%、密度为1.2g/cm3的NaOH溶液,
设氢氧化钠溶液的体积为VL,
则m=ρV=1.2g/cm3×V×103ml×10%=1.2V×102g,则n=$\frac{m}{M}$=$\frac{1.2V×1{0}^{2}}{40}$=3Vmol,所以c=$\frac{n}{V}$=3mol/L,故答案为:3mol/L;
(2)1gSO2完全转化时,放出akJ热量,1molSO2完全转化时,放出64akJ热量,热化学反应方程式2NaClO3(aq)+SO2(g)=Na2SO4(aq)+2ClO2(g)△H=-64akJ/mol,
故答案为:2NaClO3(aq)+SO2(g)=Na2SO4(aq)+2ClO2(g)△H=-64akJ/mol;
(3)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应方程式为2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2.H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能超过20℃,其目的是防止H2O2分解,
故答案为:H2O2+2ClO2+2NaOH=2NaClO2+O2↑+H2O;防止H2O2分解;
(4)得到的粗晶体经过重结晶可得到纯度更高的晶体,故答案为:重结晶;
(5)ClO2-失电子生成ClO3-,电极反应方程式:ClO2--2e-+2OH-=ClO3-+H2O,故答案为:ClO2--2e-+2OH-=ClO3-+H2O;
(6)根据方程式2NaClO3(aq)+SO2(g)=Na2SO4(aq)+2ClO2(g),H2O2+2ClO2+2NaOH=2NaClO2+O2↑+H2O
可知SO2~H2O2为1:1
设需要的17%的H2O2的质量为x g
$\frac{b}{22.4}$×5.6a%=$\frac{x×17%}{34}$ x=0.5ab
故答案为:0.5ab.
点评 本题以学生比较陌生的亚氯酸钠制备为背景,以过氧化氢法制备亚氯酸钠为主线,考察学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力考察以及在新情境下综合运用知识解决问题的能力,题目难度较大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 合理施用农药、化肥,以减少水体污染 | |
| B. | 洗菜、洗衣、淘米的水用来浇花、拖地、冲厕所 | |
| C. | 将活性炭放入硬水中使其软化 | |
| D. | 加强工业废水的排放监控,坚持达标排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 8.5 | B. | 17 | C. | 16 | D. | 34 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量 | |
| B. | 2 mol SO2(g)和1 mol O2(g)在密闭容器中充分反应,放出热量小于Q kJ | |
| C. | 增大压强或升高温度,该反应过程都能放出更多的热量 | |
| D. | 2 mol SO2(g)和1 mol O2(g)在密闭容器中充分反应,放出热量等于Q kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
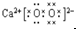 :和水反应的方程式为2CaO2+2H2O═2Ca(OH)2+O2↑;
:和水反应的方程式为2CaO2+2H2O═2Ca(OH)2+O2↑;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com