
��֪��N2��g����3H2��g�� 2NH3��g����H����92.4kJ/mol������Ŀǰ�ձ�ʹ�õ��˹��̵��ķ�������ش��������⣺
2NH3��g����H����92.4kJ/mol������Ŀǰ�ձ�ʹ�õ��˹��̵��ķ�������ش��������⣺
(1)450��ʱ����һ��2L���ܱ������г���2. 6mol H2��1mol N2�� ��Ӧ�����ж�NH3��Ũ�Ƚ��м�⣬�õ����������±���ʾ��
| ʱ��/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol��L��1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
| | N2 | H2 | NH3 |
| ��ʼŨ�ȣ�mol/L�� | 0.2 | 0.3 | 0.2 |
| ƽ��Ũ�ȣ�mol/L�� | a | b | c |
 4NH3��g����3O2��g�����˷�Ӧ�ġ�S__________0���
4NH3��g����3O2��g�����˷�Ӧ�ġ�S__________0��� ���� ��
���� �� ����=������ ��H��_____________��
����=������ ��H��_____________��
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��һ���¶��£����ݻ�����������м���2mol N2��8mol H2�����������ʹ֮��Ӧ����֪��N2��g��+3H2��g��?2NH3��g������H=-92.2kJ?mol-1��ƽ��ʱ������������ѹǿΪ��ʼʱ��80%��
��һ���¶��£����ݻ�����������м���2mol N2��8mol H2�����������ʹ֮��Ӧ����֪��N2��g��+3H2��g��?2NH3��g������H=-92.2kJ?mol-1��ƽ��ʱ������������ѹǿΪ��ʼʱ��80%��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 9N2��g��+6CO2��g��+6H2O��g����
9N2��g��+6CO2��g��+6H2O��g���� 9N2��g��+12CO2��g��+12H2O��g����
9N2��g��+12CO2��g��+12H2O��g����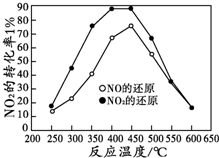
 O2+Hb?CO K=220
O2+Hb?CO K=220�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
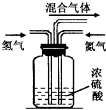 ������һ����Ҫ�Ļ���ԭ�ϣ������Ź�ҵ�����̵ļӿ죬����Ҳ��ɾ�����һ����Ҫ����Ⱦ�����壮
������һ����Ҫ�Ļ���ԭ�ϣ������Ź�ҵ�����̵ļӿ죬����Ҳ��ɾ�����һ����Ҫ����Ⱦ�����壮
| ||
| ||
| C2(NH3)?C(CO2) |
| C(H2O) |
| C2(NH3)?C(CO2) |
| C(H2O) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
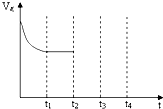 Ŀǰ��ȫ���������Ϊ�����������������������������������Ҫԭ��֮һ���������������ж��ַ������������ϰ�װ��Ч��ת��������ʹ����β���е���Ҫ��Ⱦ�CO��NOx��̼�⻯����������Ӧ�����������ʣ���������β����Ⱦ��
Ŀǰ��ȫ���������Ϊ�����������������������������������Ҫԭ��֮һ���������������ж��ַ������������ϰ�װ��Ч��ת��������ʹ����β���е���Ҫ��Ⱦ�CO��NOx��̼�⻯����������Ӧ�����������ʣ���������β����Ⱦ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com