
| A、2 L 1 mol?L-1的盐酸中所含氯化氢分子数为2NA |
| B、1L 0.1 mol?L-1的NaClO溶液中ClO-数目为0.1NA |
| C、标准状况下,11.2L乙醇完全燃烧生成的CO2分子数为NA |
| D、标准状况下,4.48 L N2所含的共用电子对数0.6NA |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
| 反应前物质质量/g | 反应后物质质量/g | |
| Cu-Zn合金 | 稀硫酸 | 滤液质量 |
| 4.0 | 10 | 11.26 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol |
| B、C(石墨,s)═C(金刚石,s)△H>0,所以金刚石比石墨稳定 |
| C、已知碳的燃烧热为ykJ/mol,当7.2g的碳在12.8g的氧气中燃烧,至反应物耗尽并放出xkJ的热量,则可求出1mol碳与氧气反应生成1mol一氧化碳气体时△H=-(2.5x-0.5y)kJ/mol |
| D、已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、NH4Cl的电子式: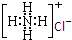 |
| B、含18个中子的氯原子的核素符号:1735Cl |
C、S2-的结构示意图: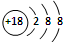 |
| D、次氯酸的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL 3mol/L KCl溶液 |
| B、25mL 2mol/L AlCl3溶液 |
| C、150mL 1mol/L NaCl溶液 |
| D、25mL 1.5mol/L MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01mol/L的CH3COOH |
| B、0.01mol/LNaHSO4 |
| C、0.01mol/LNaHCO3 |
| D、0.005mol/LH2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、290 | B、282 |
| C、280 | D、278 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、赤铁矿投入到稀盐酸中:FeO+2H+═Fe2++H2O |
| B、FeCl3溶液中加入氢氧化钠溶液:Fe2++3OH-═Fe(OH)2↓ |
| C、三氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ |
| D、FeCl2溶液跟Cl2反应:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
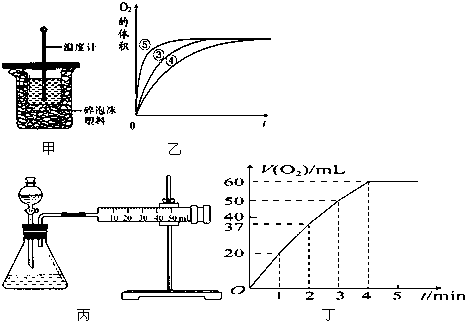 (1)中和热的测定是高中化学的定量实验之一.50mL0.50mol/L 盐酸与50mL 0.55mol/L NaOH 溶液在如图甲所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.从实验装置上看,图中尚缺少的一种仪器是
(1)中和热的测定是高中化学的定量实验之一.50mL0.50mol/L 盐酸与50mL 0.55mol/L NaOH 溶液在如图甲所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.从实验装置上看,图中尚缺少的一种仪器是| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol?L-1FeCl3溶液 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 1mL 0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol?L-1FeCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com