
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
 .
.分析 由元素在周期表中的外置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为Cl、⑨为K、⑩为Ca.
(1)被选作相对原子质量标准的核素是C-12;
(2)在最高价氧化物的水化物中,酸性最强的是高氯酸;金属性越强,最高价氧化物对应水化物的碱性越强;
(3)Al元素的氧化物--氧化铝是两性氧化物,铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(4)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大;
(5)元素③与⑤形成的具有强氧化性的化合物为Na2O2;
(6)可以根据金属与水或酸反应的难易程度、剧烈程度,最高价氧化物对应水化物的碱性强弱,金属单质之间相互置换等判断金属性强弱,物理性质不能比较金属性强弱,钠置于盐溶液中首先与水反应,不能置换盐溶液中的金属元素.
解答 解:由元素在周期表中的外置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为Cl、⑨为K、⑩为Ca.
(1)被选作相对原子质量标准的核素是C-12,该核素符号为12C,故答案为:12C;
(2)在最高价氧化物的水化物中,酸性最强的是高氯酸,化学式为HClO4,上述元素中K的金属性最强,故KOH的碱性最强,故答案为:HClO4;KOH;
(3)氧化铝是两性氧化物,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大,故离子半径:Cl->Na+>Mg2+>Al3+,故答案为:Al3+;
(5)元素③与⑤形成的具有强氧化性的化合物为Na2O2,由钠离子与过氧根离子构成,电子式为: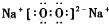 ,故答案为:
,故答案为: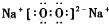 ;
;
(6)A.钠首先与水反应,不能置换盐溶液中的金属元素,不能说明Na的金属性比较Mg弱,故A错误;
B.溶解性属于物理性质,不能比较元素金属性强弱,故B错误;
C.金属单质与水反应越剧烈,对应元素的金属性越强,故C正确;
D.物质的颜色属于物理性质,不能比较金属性强弱,故D错误,
故答案为:C.
点评 本题考查元素周期表与元素周期律的综合应用,需要学生熟练掌握元素周期表的结构,注意掌握元素金属性、非金属性比较实验事实.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO2具有强还原性,可用于自来水的杀菌消毒 | |
| B. | 晶体硅具有导电性,可用于制作光导纤维 | |
| C. | MgO的熔点很高,可用于制作耐高温材料 | |
| D. | 浓硫酸具有吸水性,可用于干燥氯气、氨气等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与水反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | 小苏打与烧碱溶液反应 HCO3-+OH-═CO2↑+H2O | |
| C. | Ca(HCO3)2与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 用FeCl3溶液腐蚀铜电路板:Fe3++Cu═Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
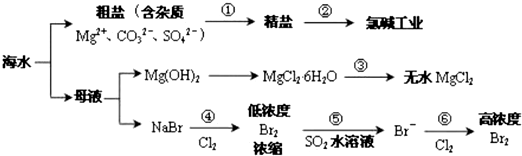
| A. | 过程①除杂的顺序:NaOH 溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程③中将MgCl2•6H2O 灼烧即可制得无水 MgCl2 | |
| C. | 在过程④、⑥反应中每氧化 0.2 mol Br- 需消耗2.24 LCl2 | |
| D. | 从第④步到第⑥步的目的是为了富集溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯能使溴水褪色 | |
| B. | 葡萄糖能发生氧化反应和水解反应 | |
| C. | CH2═CHCN通过缩聚反应得到腈纶 | |
| D. | 区别棉花和羊毛的最简单方法是灼烧闻气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li是负极,电极反应为Li-e-═Li+ | |
| B. | 锂电池属于一次性电池 | |
| C. | MnO2是正极,电极反应为MnO2+e-═MnO${\;}_{2}^{-}$ | |
| D. | 锂电池是一种环保型电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  如图装置可用于分离甲苯和液溴的混合物 | |
| B. |  如图装置可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 | |
| C. |  如图装置中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 | |
| D. |  如图装置可用于干燥、收集NH3,并吸收多余的NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com