
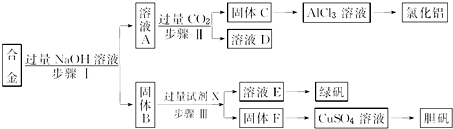
分析 铝、铁和铜的合金中只有金属铝可以和氢氧化钠之间反应生成溶液A偏铝酸钠,固体B是金属铁和金属铜,A中通入过量的二氧化碳可以得到氢氧化铝沉淀C和碳酸氢钠溶液D,金属铁可以和硫酸之间发生反应生成硫酸亚铁和氢气,但是金属铜和稀硫酸之间不反应,硫酸亚铁溶液蒸发浓缩、冷却结晶可以获得绿矾晶体,金属铜可以获得胆矾晶体,
(1)固体和液体的分离用过滤法,过滤用到的仪器:烧杯、玻璃棒、漏斗等;
(2)根据步骤Ⅰ加过量的氢氧化钠发生的反应以及金属铁、铜的性质区别进行解答;
(3)偏铝酸根离子与过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢根离子,据此写出反应的离子方程式;
(4)根固体F为铜,根据铜、稀硫酸的性质来判断反应的发生,并结合质量守恒定律写出该反应的化学方程式.
解答 解:铝、铁和铜的合金中只有金属铝可以和氢氧化钠之间反应生成溶液A偏铝酸钠,固体B是金属铁和金属铜,A中通入过量的二氧化碳可以得到氢氧化铝沉淀C和碳酸氢钠溶液D,金属铁可以和硫酸之间发生反应生成硫酸亚铁和氢气,但是金属铜和稀硫酸之间不反应,硫酸亚铁溶液蒸发浓缩、冷却结晶可以获得绿矾晶体,金属铜可以获得胆矾晶体,
(1)步骤Ⅰ加过量的氢氧化钠,金属铝和氢氧化钠反应,金属铝溶解其中生成偏铝酸钠溶液,金属铁和金属铜不与氢氧化钠反应,将它们分离用过滤;步骤Ⅰ过滤得到的滤液成分为偏铝酸钠,步骤Ⅱ中向偏铝酸钠中通入足量的二氧化碳,会得到纯净的氢氧化铝沉淀,溶液中的溶质为碳酸氢钠,将它们分离用过滤;步骤Ⅲ中金属铁和金属铜不与氢氧化钠反应,铁和硫酸反应而金属铜不反应将它们分离用过滤,过滤用到的玻璃仪器:烧杯、玻璃棒、漏斗等,
故答案为:过滤;玻璃棒、漏斗;
(2)步骤Ⅰ加过量的氢氧化钠,因铝与碱反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,金属铁和金属铜不与氢氧化钠反应,所以溶液A中的离子主要有AlO2-、Na+、OH-,则含有的阴离子为:AlO2-、OH-;
本实验的目的是用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4•7H2O)和胆矾晶体,金属铁和金属铜不与氢氧化钠反应,铁和硫酸反应生成硫酸亚铁而金属铜不反应,可以实现三种金属的分离,所以试剂X是稀硫酸,
故答案为:AlO2-、OH-;稀硫酸;
(3)溶液A中含有偏铝酸钠,偏铝酸钠溶液中通入过量CO2气体生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+CO2+H2O═2Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+H2O═2Al(OH)3↓+HCO3-;
(4)依据流程图可知:固体F为铜,铜不能和稀硫酸反应,但是当加热并通入空气之后,铜和氧气反应生成氧化铜,然后氧化铜会和硫酸反应生成硫酸铜,不会产生污染大气的气体,硫酸铜溶液是蓝色的,由于各反应物是混合接触在一起的,这两个反应是同时进行的,所以氧化铜没机会单独的存在,故我们可以认为反应物为氧气、铜和硫酸,而生成物为硫酸铜和水,故该反应的化学方程式为:2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O,
故答案为:2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O.
点评 本题考查了物质分离与提纯方法的综合应用,题目难度中等,根据实验流程明确实验目的、实验原理为解答关键,注意熟练掌握化学实验基本操作方法,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
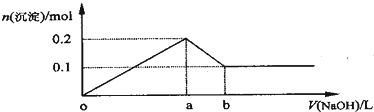
| A. | NaOH的浓度为0.6 mol•L-1 | B. | 在a点处溶液中的溶质为NaCl | ||
| C. | 混合溶液中n(Al3+):n(Mg2+)=2:1 | D. | 图中线段oa:ab=5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
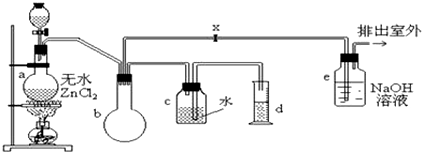
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于分子间作用力的存在,因而CO2在加热条件下不易发生分解 | |
| B. | 非金属原子间不可能形成离子化合物 | |
| C. | 在PCl3分子中各原子都达到8电子稳定结构 | |
| D. | 离子化合物中可能存在共价键,共价化合物中也可能存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5min内P的平均反应速率为0.15mol/(L•min) | |
| B. | Q的平衡浓度为1mol/L | |
| C. | Q的转化率为25% | |
| D. | x是2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com