
| A. | 均三甲苯在核磁共振氢谱中能出现两组峰,且其峰面积之比为3:1 | |
| B. | 按系统命名法,化合物 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 | |
| C. | 乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴别两者 | |
| D. | 肌醇 与葡萄糖 与葡萄糖 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 |
分析 A.3个甲基相同,苯环上只有1种H;
B.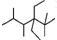 的主链含6个C,2,2,4,5号C含甲基,3号C有2个乙基;
的主链含6个C,2,2,4,5号C含甲基,3号C有2个乙基;
C.乙醇和二甲醚分子式相同,结构不同,乙醇含有羟基,乙醚含有醚基;
D.肌醇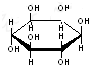 中只含-OH,不属于糖类化合物.
中只含-OH,不属于糖类化合物.
解答 解:A.均三甲苯中3个甲基相同,苯环上只有1种H,则核磁共振氢谱中能出现两组峰,且其峰面积之比为9:3=3:1,故A正确;
B. 的主链含6个C,2,2,4,5号C含甲基,3号C有2个乙基,名称为2,2,4,5-四甲基-3,3-二乙基己烷,故B正确;
的主链含6个C,2,2,4,5号C含甲基,3号C有2个乙基,名称为2,2,4,5-四甲基-3,3-二乙基己烷,故B正确;
C.乙醇和二甲醚分子式相同,结构不同,乙醇含有羟基,乙醚含有醚基,可用红外光谱法或核磁共振氢谱法鉴别,故C正确;
D.肌醇 中只含-OH,不属于糖类化合物,属于醇类物质,而葡萄糖为糖类物质,故D错误;
中只含-OH,不属于糖类化合物,属于醇类物质,而葡萄糖为糖类物质,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重结构对称性、有机物类别的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 2:3 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的溶液时,若摇匀后发现液面低于刻度线,要再用胶头滴管加水至刻度线 | |
| B. | 除去FeCl2溶液中的少量FeBr2,可先加入适量氯水,再用CCl4萃取分液 | |
| C. | 为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用 | |
| D. | 向溶液中先加入KSCN溶液无明显现象,再加入新制氯水,溶液呈红色,证明原溶液中含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28 g氮气含有的原子数为NA | |
| B. | 4 g金属钙变成钙离子时失去的电子数为0.1NA | |
| C. | 1 mol O2分子的质量等于1 mol氧原子的质量 | |
| D. | 24 g O2分子和24 g O3分子所含的氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种中学常见的物质,皆由短周期元素组成,有如图的转化关系.
A、B、C、D、E、F六种中学常见的物质,皆由短周期元素组成,有如图的转化关系.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验中需用0.20 mol•L-1的NaOH溶液950mL,配制时应称取NaOH的质量8.0g | |
| B. | 升高NH4Cl溶液温度,其水的离子积常数和pH均增大 | |
| C. | 水比硫化氢稳定的原因是水分子间存在氢键 | |
| D. | 在pH等于2的醋酸溶液中加入少量0.01 mol•L-1的稀盐酸,溶液的pH会变小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com