
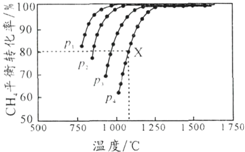
 向密闭容器中充入物质的量浓度均为 0.1mol/L的CH4和 CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )
向密闭容器中充入物质的量浓度均为 0.1mol/L的CH4和 CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )| A. | 平衡时CO与H2的物质的量比为1:1 | |
| B. | p1、p2、p3、p4由小到大的顺序为p1<p2<p3<p4 | |
| C. | 1100℃,p4条件下,该反应10 min时达到平衡点X,则ν(CO2)=0.008 mol•L-1•min-1 | |
| D. | 随着温度升高,该反应的平衡常数减小 |
分析 A.根据生成物CO与H2的物质的量按1:1生成判断;
B.由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),据此结合方程式判断压强对平衡移动的影响进行解答;
C.由图可知,压强为P4、1100℃的条件下,到达平衡X点时甲烷的转化率为80%,据ν(CO2)=$\frac{△c}{△t}$计算;
D.由图可知,温度越高,CH4的平衡转化率越大,说明升温平衡向正反应方向移动,据此判断.
解答 解:A.因为生成物CO与H2的物质的量按1:1生成,所以平衡时CO与H2的物质的量比为1:1,故A正确;
B.由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P4>P3>P2>P1,故B正确;
C.由图可知,压强为P4、1100℃的条件下,达到平衡X点时甲烷的转化率为80%,甲烷的浓度变化量为0.1mol/L×80%=0.08mol/L,则:
CH4(g)+CO2(g)=2CO(g)+2H2(g),
开始(mol/L):0.1 0.1 0 0
变化(mol/L):0.08 0.08 0.16 0.16
平衡(mol/L):0.02 0.02 0.16 0.16
故ν(CO2)=$\frac{△c}{△t}$=$\frac{0.08mol/L}{10min}$=0.008 mol•L-1•min-1,故C正确;
D.由图可知,温度越高,CH4的平衡转化率越大,说明升温平衡向正反应方向移动,所以温度升高,该反应的平衡常数增大,故D错误;
故选D.
点评 本题考查化学平衡图象、影响化学平衡的因素、化学平衡常数等,难度中等,注意利用“定一议二”原则分析解答.


科目:高中化学 来源: 题型:选择题
| 实验操作及现象 | 实验结论 | |
| A | 将SO2通入品红溶液中,红色逐渐褪去;再加热已褪色的溶液,溶液又恢复为红色 | 生成的亚硫酸不稳定 |
| B | 向某盐溶液中加入浓NaOH溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝色 | 原溶液中含有NH+4 |
| C | 在某硝酸盐溶液中加入少量稀H2SO4,酸化,再滴加几滴KSCN溶液,溶液变红色 | 原硝酸盐为Fe(NO3)3 |
| D | 将淀粉液和稀硫酸混合微热:一段时间后加入银氨溶液,振荡,水溶加热,试管内壁未出现银镜 | 淀粉一定尚未水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,E、H中所含官能团的名称分别是羟基、碳碳双键.
,E、H中所含官能团的名称分别是羟基、碳碳双键. +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$ +H2O、n
+H2O、n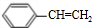 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$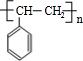 .
. (写出其中一种的结构简式).
(写出其中一种的结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 72 | B. | 53 | C. | 19 | D. | 125 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
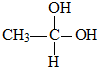 →CH3-CHO+H2O
→CH3-CHO+H2O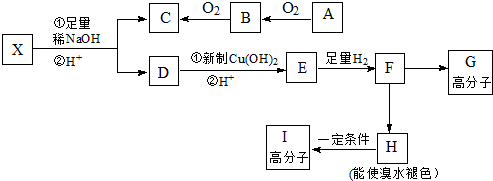
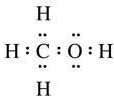 .
. ;
;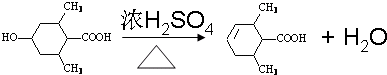 ;
;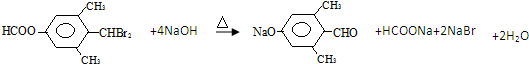 ;
;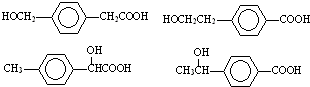 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
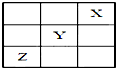 元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素基态原子的外围电子排布为ns(n-1)np(n+1),则下列说法错误的是( )
元素X、Y、Z在周期表中的相对位置如图所示:已知Y元素基态原子的外围电子排布为ns(n-1)np(n+1),则下列说法错误的是( )| A. | X元素所在周期中所含非金属元素最多 | |
| B. | Y元素在周期表的第3周期ⅥA族 | |
| C. | Y元素基态原子的价电子排布为4s24p4 | |
| D. | Z元素基态原子的核外电子排布式为1s22s22p63s23p63d104s24p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 C>D>B>A | B. | 原子序数 a>b>d>c | ||
| C. | 离子半径 A>B>D>C | D. | 元素失电子能力 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
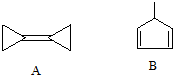
| A. | A的化学式为C6H8 | B. | A的二氯取代产物有4种 | ||
| C. | A与B与溴水反应产物都只有一种 | D. | A分子所有碳原子均在同一平面上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com