
【题目】铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜版腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式____________________________________。
(2)若将(1)中的反应设计成如图所示原电池,则负极反应式为:_____________________,正极反应式:________________________;电子从_______流向________(填“Cu”或“石墨”)。

(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,完成除去CuCl2溶液中Fe3+和Fe2+的实验步骤。
①通入足量_________将Fe2+氧化为Fe3+。
②加入_________调节溶液的pH至3.2~4.7,使______________ 完全沉淀然后过滤。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
【答案】 2Fe3++Cu=2Fe2++Cu2+ Cu-2e-=Cu2+ 2Fe3++2e-=2Fe2+ Cu 石墨 氯气 CuO Fe(OH)3(Fe3+也可给分)
【解析】(1)FeCl3溶液与铜反应生成氯化亚铁和氯化铜;正确答案:2Fe3++Cu=2Fe2++Cu2+。
(2). 2Fe3++Cu=2Fe2++Cu2+根据反应看出,金属铜做原电池的负极,发生氧化反应:Cu-2e-=Cu2+,溶液中的Fe3+在正极得电子,发生还原反应: 2Fe3++2e-=2Fe2+;电子由负极铜流出经过导线进入正极石墨;正确答案:Cu-2e-=Cu2+ ;2Fe3++2e-=2Fe2+ ; Cu ;石墨 。
(3)①通入氯气或滴加氯水,把Fe2+氧化为Fe3+,还不引入杂质阴离子;正确答案:氯气。调节溶液的pH,使Fe3+全部变为沉淀,而Cu2+不沉淀;满足这样的条件的试剂必须不溶于水,能够与酸反应,而且反应后不引入新杂质,可以加入含有铜元素的不溶于水的化合物氧化铜,金属铜与稀盐酸不反应; 正确答案:氧化铜;Fe3+ 或Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeCO3F)为原料制备CeO2的一种工艺流程如下:

已知:i.Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSOa4]2+;
ii.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能
iii.常温下,Ce2(CO3)3饱和溶液浓度为1.0×10-6mol/L。请回答下列问题:
(1)铈的原子序数是58,它在元素周期表的位置是_________________________。
(2)“氧化焙烧”过程中可以加快反应速率和提高原料利用率的方法是____________________、_________________(写出2种即可)。
(3)“氧化焙烧”产物CeO2与稀H2SO4反应的离子方程式为________________。浸出的过程中常加入适量的Na2SO4浓溶液,其作用是_____________________________。
(4)“萃取”时存在反应:Ce4++n(HA)2![]() Ce(H2n-4A2n)+4H+。萃取后水层中还存在的含铈元素的微粒主要是__________,经处理后可循环使用。
Ce(H2n-4A2n)+4H+。萃取后水层中还存在的含铈元素的微粒主要是__________,经处理后可循环使用。
(5)“反萃取”中加H2O2的主要反应离子方程式为_______________________。在“反萃取”后所得水层中加入1.0mol/L的NH4HCO3溶液,产生Ce2(CO3)3沉淀,当Ce3+沉淀完全时[c(Ce3+)=1×10-5mol/L],溶液中c(CO32-)约为______________。
(6)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。请写出CeO2消除CO尾气的化学方程式_____________________________。
CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。请写出CeO2消除CO尾气的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是重要的有机合成中间体,H为高分子化合物,其合成路线如图所示:

已知:① (R为烃基);
(R为烃基);
②2R-CH2CHO![]()
![]() 。
。
请回答下列问题:
(1)J的名称为____________。E中所含官能团的名称为____________。H的结构简式为____________。
(2)C→D涉及的反应类型有____________________________。
(3)A→B+F的化学方程式为___________________________________。
(4)D与银氨溶液反应的化学方程式为______________________________________________。
(5)符合下列条件的M的同分异构体有____________种(不考虑立体异构)。
①官能团种类和数目与M相同
②分子中含有1个-CH3和1个-CH2CH2-
③不含-CH2CH2CH2-
(6)请结合所学知识和上述信息,写出以苯甲醛和一氯乙烷为原料(无机试剂任选),制备苄基乙醛(![]() )的合成路线:_________________________________________________。
)的合成路线:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解饱和硫酸铜溶液,装置由右图所示,则直流电源左端为______极(填“正”或“负”),b电极的电极反应式为:_______________;电解一段时间后,电解质溶液的pH_______(填“变大”、“变小”或“不变”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
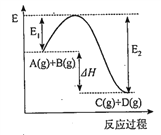
(1)该反应是___________反应(填“吸热”或“放热”)。
(2)△H=_______________。
(3)反应体系中加入催化剂对反应热是否有影响?___________________(填“有影响”“无影响”)。
(4)升高温度,该反应的平衡常数K将_________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产碳酸饮料时常加入防腐剂NaA,再加压充入CO2。已知室温下,HA的Ka=6.3×10-5,H2CO3的Ka1=4.2×10-7,Ka2=4.9×10-11,下列说法正确的是
A. 充入CO2能使溶液中c(A-)增大
B. 当c(H+)= 6.3×10-5,饮料中 =1
=1
C. 充入CO2时发生反应;CO2+H2O+A-==HA+HCO3-
D. 该饮料中粒子浓度关系为:c(HA)+c(H+)=c(OH-)+c(HCO3-)+2(CO32- )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com