
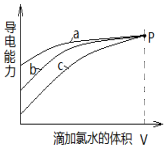
| A. | 曲线a代表H2SO3溶液 | |
| B. | 曲线b代表的溶液中:c(Na+)═c(H2SO3)+c(HSO3-)+c(SO32-)+c(SO42-) | |
| C. | 曲线a、b、c代表的溶液中均始终保持:2c(Cl-)=c(SO42-) | |
| D. | 当滴加氯水体积均为V时,三种溶液的导电能力基本相同,c(H+)也相同 |
分析 相同物质的量浓度、相同体积的H2SO3、NaHSO3、Na2SO3三种溶液中,存在电离方程式为:H2SO3?H++HSO3-、NaHSO3=Na++HSO3-、Na2SO3=2Na++SO32-,溶液中离子浓度越大,溶液的导电性越强,由图可知曲线a代表Na2SO3溶液、曲线b代表NaHSO3溶液、曲线c代表Na2SO3溶液,滴加同一新制氯水,三种溶液中S元素均被氧化为SO42-;据此分析.
解答 解:A.由分析可知,a代表Na2SO3溶液,故A错误;
B.曲线b代表NaHSO3溶液,由物料守恒可知,Na元素的物质的量浓度等于S的物质的量浓度,则c(Na+)═c(H2SO3)+c(HSO3-)+c(SO32-)+c(SO42-),故B正确;
C.1mol氯气与1moH2SO3或NaHSO3或Na2SO3恰好反应生成2molHCl和1molSO42-,则c(Cl-)=2c(SO42-),故C错误;
D.1mol氯气与1moH2SO3恰好反应生成2molHCl和1molH2SO4,1mol氯气与1moNa2SO3恰好反应生成2molHCl和1molNa2SO4,所以溶液中c(H+)不相同,故D错误.
故选B.
点评 本题考查了氧化还原反应、溶液导电性的判断,侧重考查学生分析判断及识图能力,明确发生的反应及各点溶液中溶质成分是解本题关键,注意:溶液导电能力与离子浓度成正比,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Penguinone分子 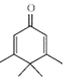 所有碳原子不可能都在同一个平面上 所有碳原子不可能都在同一个平面上 | |
| B. | 1mol  分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为5 mol、3 mol、1 mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为5 mol、3 mol、1 mol | |
| C. | 醋酸和软脂酸互为同系物,C5H12和C9H20也一定互为同系物 | |
| D. | 石油的裂化、裂解属于化学变化,煤的气化、液化则属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
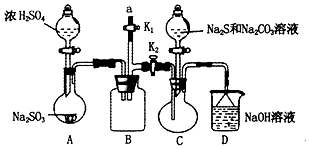 硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化.某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3.
硫代硫酸钠(Na2S2O3)是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性条件下易分解,在空气中易被氧化.某化学兴趣小组通过如图装置(省略夹持装置)制备Na2S2O3.| 实验序号 | 溶液pH | 亚硫酸钠与水的质量比 | 反应温度 | 硫粉质量 | 亚硫酸钠转化率 |
| 1 | 10 | 1.5:1 | 100℃ | 18 | 80.7% |
| 2 | 10 | 1.1:1 | 100℃ | 18 | 94.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 《电石安全技术说明书》中对电石的描述为“…遇水或湿气能迅速产生高度易燃的乙炔气体,应与氧化剂类物质分开存放…”.下列说法不合理的是( )
《电石安全技术说明书》中对电石的描述为“…遇水或湿气能迅速产生高度易燃的乙炔气体,应与氧化剂类物质分开存放…”.下列说法不合理的是( )| A. | 盛装电石的包装上贴有的危险化学品标志为: | |
| B. | 电石与硝酸分开存放 | |
| C. | 运输电石的铁桶内可充入氮气 | |
| D. | 电石着火可用泡沫灭火器扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
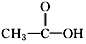 和
和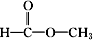 两种.为对其结构进行鉴定,物理方法可用红外光谱法或核磁共振氢谱法.
两种.为对其结构进行鉴定,物理方法可用红外光谱法或核磁共振氢谱法.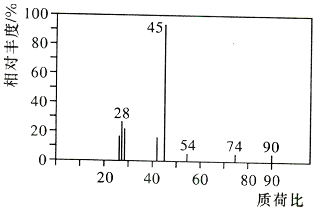
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使pH试纸变深蓝色的溶液:Na+、AlO2-、S2-、CO32- | |
| B. | Na2S溶液中:K+、Na+、NO3-、Ag+ | |
| C. | 含有大量Al3+的水溶液中:Na+、NH4+、HCO3-、Br- | |
| D. | 水电离产生的H+浓度为1×10-12mol•L-1的溶液:NH4+、Na+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
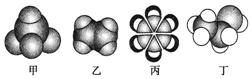
| A. | 甲能使酸性KMnO4溶液褪色 | |
| B. | 乙可与溴水发生取代反应而使溴水褪色 | |
| C. | 丙可以从煤焦油中获得 | |
| D. | 丁在稀硫酸作用下可与乙酸发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体 | B. | 原子晶体 | C. | 分子晶体 | D. | 金属晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com