
|
已知破坏1 mol N≡N键、H-H键和N-H键分别需要吸收的能量为946 kJ、436 kJ、391 kJ.则N2和H2反应生成1 mol NH3时,能量改变的理论值为 | |
| [ ] | |
A. |
吸收能量46 kJ |
B. |
吸收能量92 kJ |
C. |
放出能量46 kJ |
D. |
放出能量92 kJ |
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源:江西省上饶市第五中学2010-2011学年高一下学期期中考试化学试题 题型:013
|
已知破坏1 mol H-H键、Cl-Cl键分别需要吸收436 kJ、243 kJ、断裂1 mol H-Cl键要吸收432 kJ能量,则由H2与Cl2生成1 mol HCl总的过程需要 | |
| [ ] | |
A. |
放热185 kJ |
B. |
吸热185 kJ |
C. |
放热92.5 kJ |
D. |
吸热92.5 kJ |
查看答案和解析>>
科目:高中化学 来源:四川省金堂中学2011-2012学年高二下学期期中考试化学试题 题型:058
化学键的键能是指气态原子间形成1 mol化学键时释放的能量.如:H(g)+I(g)→H-I(g)+297 KJ即H-I键的键能为297 kJ/mol,也可以理解为破坏1 mol H-I键需要吸收297 KJ的热量.化学反应的发生可以看成旧化学键的破坏和新化学键的形成.下表是一些键能数据.(单位:kJ/mol)
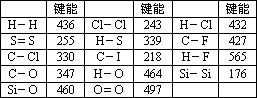
阅读上述信息,回答下列问题:
(1)根据表中数据判断CCl4的稳定性________(填“大于”或“小于”)CF4的稳定性.试预测C-Br键的键能范围________<C-Br键能<________
(2)有人认为:H-O键的键能大于H-S键的键能,所以H2O的熔沸点高于H2S的熔沸点.你是否赞同这种观点?如不赞同,请说出你的解释.________.
(3)已知H2O(l)=H2O(g) ΔH=+44 kJ/mol,请写出表示氢气燃烧热的热化学方程式:________.
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省鹤岗一中高一下学期期中考试化学试卷(带解析) 题型:单选题
已知反应A2+B2===2AB,破坏1 mol A2中的化学键消耗的能量为Q1 kJ,破坏1 mol B2中的化学键消耗的能量为Q2 kJ,形成1 mol AB中的化学键释放的能量为Q3 kJ,则下列说法正确的是( )
| A.若该反应为吸热反应,则Q1+Q2<2Q3 |
| B.若该反应为放热反应,则Q1+Q2>Q3 |
| C.若A2和B2的总能量之和小于生成的AB的总能量,则反应放热 |
| D.若A2和B2的总能量之和大于生成的AB的总能量,则反应放热 |
查看答案和解析>>
科目:高中化学 来源:2013届山东省潍坊市高二寒假作业化学(一)试卷 题型:填空题
利用化学反应原理研究生产、生活中的实际问题具有十分重要的意义:
(Ⅰ)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g)  2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
(1)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量_____92 kJ(填“大于”“等于”或“小于”),原因是_______;若加入催化剂,ΔH (填“变大”“变小”或“不变”)。
(2)已知:分别破坏1 mol N≡N键、1 mol H—H键需要吸收的能量为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为______kJ。
(3)N2H4可视为:NH3分子中的H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
则:1 mol N2H4完全反应的热化学方程式为 。
(Ⅱ)某铅蓄电池的正、负极标记被磨损。试用下图装置设计实验,识别出此铅蓄电池的正负极。
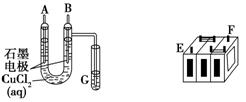
(1)若A接E,B接F,而B电极出现 ,反应式为 ,则说明F为正极;
(2)若铅蓄电池工作时(放电),其E所在电极的电极反应式为: ,充电时该极与外加电源的 极相连。
(3)若用该电池电解Cu(NO3)2 溶液,其电解方程式为
若有0.2mol电子发生转移,则正极消耗的PbO2的物质的量是 ;要想CuSO4溶液恢复原样,需加入的物质是 ,质量为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com