
| A. | S2和S8的混合物共6.4g,其中所含的电子数一定为3.2NA | |
| B. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| C. | 24g二氧化硅晶体中含有SiO2分子数为0.4NA | |
| D. | 5.6g Fe与含0.2mol HNO3的溶液充分反应,至少失去电子数为0.2NA |
分析 A、S2和S8均由S原子构成,且S原子中含16个电子;
B、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4;
C、二氧化硅为原子晶体;
D、5.6g铁为0.1mol,和0.2mol硝酸反应时,无论硝酸的还原产物为什么,硝酸均不足.
解答 解:A、S2和S8均由S原子构成,故6.4g混合物中含有的S原子的物质的量为0.2mol,而且S原子中含16个电子,故0.2molS原子中含3.2NA个电子,故A正确;
B、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4,导致分子个数减小,故分子个数小于2NA个,故B错误;
C、二氧化硅为原子晶体,不含二氧化硅分子,故C错误;
D、5.6g铁为0.1mol,和0.2mol硝酸反应时,无论硝酸的还原产物为什么,硝酸均不足,故铁过量,不能完全反应,则转移的电子数小于0.2NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )| A. | 杠杆为导体和绝缘体时,均为A 端高B 端低 | |
| B. | 杠杆为导体和绝缘体时,均为A 端低B 端高 | |
| C. | 当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低 | |
| D. | 当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
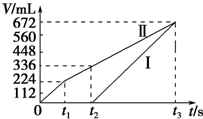 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化合物 | Mg(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| Ksp近似值 | 10-11 | 10-16 | 10-38 | 10-33 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素既可以形成阴离子,也可以形成阳离子 | |
| B. | 金属元素只能形成阳离子 | |
| C. | 分子式相同的物质化学性质相同 | |
| D. | 单核阳离子,其最外层均具有2电子或8电子的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 | |
| B. | 电解熔融氧化铝、粗硅的制取、生物炼铜、煤焦油中提取苯等过程都涉及化学变化 | |
| C. | 从2016年1月1号开始浙江省汽油标准由“国Ⅳ”提高到“国V”,但这并不意味着汽车不再排放氮氧化物 | |
| D. | 纳米技术、分子设计技术的发展,将使分子晶体管、分子芯片、分子导线、分子计算机等化学器件得到广泛的应用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com