
| A. | 一定量的Na与O2完全反应生成1mol产物时,转移电子数为2NA | |
| B. | 23g乙醇与足量金属钠完全反应时,可生成5.6L氢气 | |
| C. | 1molHCl气体与1molNH3完全反应时,可生成NA个NH4Cl分子 | |
| D. | 若1molCH4与1molCl2光照下充分反应,则生成的一氯甲烷分子的数目为NA |
分析 A、钠和氧气反应生成的产物,无论是氧化钠还是过氧化钠,1mol中均含2mol钠离子;
B、氢气所处的状态不明确;
C、氯化铵是离子化合物,无氯化铵分子;
D、甲烷和氯气反应,除了生成一氯甲烷,还生成二氯甲烷、三氯甲烷和四氯化碳.
解答 解:A、钠和氧气反应生成的产物,无论是氧化钠还是过氧化钠,1mol中均含2mol钠离子,故转移2mol电子即2NA个,故A正确;
B、氢气所处的状态不明确,故23g乙醇即0.5mol乙醇和足量钠反应生成的0.25mol氢气的体积无法计算,不一定是5.6L,故B错误;
C、氯化铵是离子化合物,无氯化铵分子,1molHCl气体与1molNH3完全反应时,可生成1molNH4Cl,故C错误;
D、甲烷和氯气反应,除了生成一氯甲烷,还生成二氯甲烷、三氯甲烷和四氯化碳,故1mol甲烷和1mol氯气反应生成的一氯甲烷分子小于NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 3≤原子最外层电子数<8的元素一定是非金属元素 | |
| B. | 原子最外层只有2个电子的元素一定是第ⅡA族元素 | |
| C. | 最外层电子数比次外层电子数多的元素一定是第二周期元素 | |
| D. | 某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- |
| A. | 在pH<4的溶液中,碳钢主要发生析氢腐蚀 | |
| B. | 在pH>6的溶液中,碳钢主要发生吸氧腐蚀 | |
| C. | 在pH>14的溶液中,碳钢腐蚀的正极反应为O2+4OH-+4e-═2H2O | |
| D. | 在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | KHC2O4溶液呈弱碱性 | |
| B. | B点时:c(K+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-) | |
| C. | C点时:c(K+)<c(HC2O4- )+2c(C2O42-)+c(H2C2O4) | |
| D. | D点时:c(H+)+c(HC2O4-)+c(H2C2O4)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
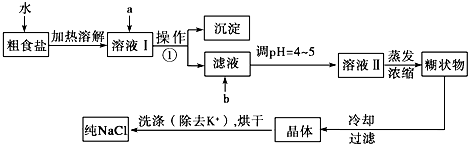
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
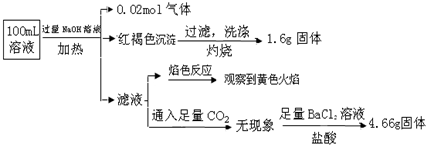
| A. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| B. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L-1 | |
| C. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 | |
| D. | 取少量原溶液于试管中,加入KSCN溶液,溶液成血红色,说明该溶液一定没有Fe2+,只有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
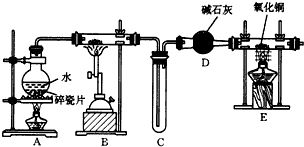
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


| 时间 (s) 浓度 mol•L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | C1 | 0.10 | C3 | C4 | C5 |
| C(NO2) | 0.00 | 0.12 | C2 | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com