
【题目】如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素,下列关这四种元素及其化合物的说法中正确的是

A. X、Y、Z、W可能均为金属元素
B. 气态氢化物的稳定性Z>W>X>Y
C. W的最高正化合价与负化合价的绝对值可能相等
D. Z的最高价氧化物的水化物可能为强碱
科目:高中化学 来源: 题型:
【题目】实验题
甲同学拟通过实验探究同主族元素性质的递变规律。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂: NaBr溶液、NaI溶液、新制的氯水
(1)实验目的:
①写出下列实验报告中的实验现象和离子方程式
实验步骤 | 实验现象 | 实验结论及离子方程式 |
| 甲___________ 乙___________ | 离子方程式 甲___________ 乙___________ 结论:卤素单质的氧化性由强到弱的顺序为Cl2>Br2>I2 |
②【评价】甲同学设计的实验方案的合理性是___________(填序号)
A. 非常合理 B. 部分合理 C. 完全不合理
③【补充和完善】上一题②中若选A,则此项不用再作答,若选B或C,则完成实验还需要的试剂是___________。
(2)下表是元素周期表主族元素的一部分,短周期元素X的最高正化合价是+5,Y的单质可在空气中燃烧。
W | X | Y |
Z |
请回答下列问题:
①写出Z的原子结构示意图:__________________。
②探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中用Z表示即可) _____
编号 | 性质推测 | 化学方程式 |
示例 | 氧化性 | H2ZO3+4HI===Z↓+2I2+3H2O |
1 | ||
2 |
③由C、O和Y三种元素组成的化合物COY中,所有原子的最外层都满足8电子结构。写出该化合物的电子式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表所示:
实验编号 | HA物质的量浓度(mol*L﹣1) | NaOH物质的量浓度(mol*L﹣1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
请回答:
(1)从①组情况表明,HA是(填“强酸”或“弱酸”).
(2)②组情况表明,c0.2(选填“大于”、“小于”或“等于”).混合液中离子浓度c(A﹣)与c(Na+)的大小关系是 .
(3)从③组实验结果分析,说明HA的电离程度NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是 .
(4)①组实验所得混合溶液中由水电离出的c(OH﹣)与溶液中的c(OH﹣)之比为 . 写出该混合溶液中下列算式的精确结果(不能近似计算):c(Na+)﹣c(A﹣)=molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g) ![]() 2CO2(g)+S(l)△H<0若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
2CO2(g)+S(l)△H<0若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中列出10种元素在周期表中的位置,回答下列问题。
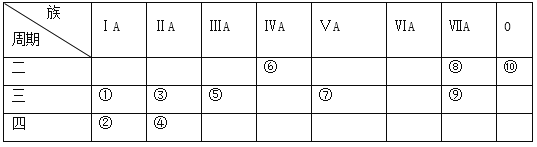
(1)这10种元素中,化学性质最不活泼的元素是____(写序号),得电子能力最强的原子是____(用元素符号表示);元素⑦的最高价氧化物对应的水化物是______(写化学式)。
(2)元素④的离子结构示意图为____________________________。
(3)①、⑧、⑨三种元素单核离子半径由大到小的顺序是(用离子符号表示)_____________。
(4)请写出:
(ⅰ)③的单质置换出⑥的单质的化学方程式:___________________________。
(ⅱ)①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式:__________________。
(ⅲ)②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学想利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响.部分实验用表如下:
实验 | 温度/K | 盐酸浓度 | 醋酸浓度/molL﹣1 | 实验目的 |
① | 298 | 0.20 | a.实验①和②,探究温度对反应速率的影响; | |
② | 308 | 0.20 | ||
③ | 298 | 0.40 | ||
④ | 0.20 | |||
⑤ | 0.20 |
(1)请完成上工作表(填写实验④⑤的空格).
(2)上表实验①中,镁条消失的时间为20s.实验过程中,镁条剩余质量与时间关系如图:
Ⅰ假设反应过程中盐酸体积不变,则要计算该反应的速率v(HCl),尚缺少的数据是 .
(3)Ⅱ若反应温度每升高10℃,反应速率增大到原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在图中大致画出“实验②”、“实验④中醋酸实验”的镁条质量与时间关系曲线,并用②或④注明曲线代表的实验(假设实验中所用镁完全相同,且镁均能完全溶解).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为( )
A.V(酸)=102V(碱)
B.V(碱)=102V(酸)
C.V(酸)=2V(碱)
D.V(碱)=2V(酸)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有下列5种溶液
① | ② | ③ | ④ | ⑤ |
0.1molL﹣1CH3COOH溶液 | 0.01molL﹣1CH3COOH溶液 | pH=3的CH3COOH溶液 | 0.1molL﹣1NaOH溶液 | 0.1molL﹣1氨水 |
回答下列问题:
(1)溶液①稀释到原来的100倍后的溶液pH③溶液的pH(填“>”或“=”或“<”,下同),①和④两溶液中水电离出的c(H+):①④,
(2)在相同温度时,10mL ①的溶液与100mL ②的溶液相比较,下列数值后者大于前者的是(填字母).
A.中和时所需NaOH的量
B.电离程度
C.水电离出的c(H+)
D.CH3COOH的物质的量
(3)用水稀释 ⑤时,溶液中随着水量的增加而减小的是(填字母).
A.c(OH﹣)
B.![]()
C.c(H+)和c(OH﹣)的乘积
D.OH﹣的物质的量
(4)在体积相等、pH相等的 ③溶液与盐酸溶液中加入足量Zn,③溶液中产生的气体比盐酸中产生的气体(填“多”、“少”或“相等”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com