
| A. | Mg2+的数目减少 | B. | Mg2+的浓度增大 | ||
| C. | 溶液pH不变 | D. | Mg(OH)2固体质量不变 |
分析 向悬浊液中加少量MgO,发生:MgO+H2O=Mg(OH)2,消耗水,溶液中c(Mg2+)、c(OH-)增大,由于原溶液已达到饱和,则沉淀溶解平衡向逆反应方向移动,故各离子的数目减少,但是饱和溶液的浓度只与温度有关,故浓度保持不变.
解答 解:向悬浊液中加少量生石灰,发生:MgO+H2O=Mg(OH)2,
A.加入MgO,消耗水,由于原溶液已达到饱和,则平衡向逆反应方向移动,溶液中Mg2+数目减少,故A正确;
B.反应后仍为饱和溶液,c(Mg2+)不变,故B错误;
C.反应后仍为饱和溶液,c(OH-)不变,溶液pH不变,故C正确;
D.加入MgO,消耗水,Mg(OH)2固体析出,故D错误;
故选AC.
点评 本题考查难溶电解质的溶解平衡,题目难度一般,要注意向悬浊液中加少量生石灰,发生的反应:MgO+H2O=Mg(OH)2,从平衡移动的角度分析.


科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+C2H5OH→CH3COOCH2CH3+H2O 取代反应 | |
| B. | CH2=CH2+O2→CH3COOH 加成反应 | |
| C. | CH3CH2OH+CH3CH2OH→CH3CH2OCH2CH3+H2O 酯化反应 | |
| D. | C6H6+HNO3→C6H5-NO2+H2O 氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氢气的燃烧热为△H=-241.8 kJmol-1 | |
| B. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 | |
| C. | H2O(l)分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | 2 mol H2(g)与1 mol O2(g)所具有的总能量比 2 mol H2O(g)所具有的总能量低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Cu(OH)2悬浊液中加入少量CuSO4粉末,平衡向左移动,溶液中离子的总浓度会减小 | |
| B. | 当溶液中c(Cu2+)•c2(OH-)=2.0×10-20时,此溶液一定为Cu(OH)2的饱和溶液 | |
| C. | 若使0.02 mol•L-1的CuSO4溶液中生成Cu(OH)2沉淀,应调整溶液的pH≥5 | |
| D. | 向Cu(OH)2悬浊液中加入Na2S溶液,蓝色沉淀变成黑色,证明此条件下K甲(CuS)>K甲[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
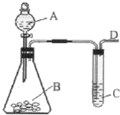 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 6 | ||
| C. | 2 | D. | 不可能出现此情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S不变,K变大,O2转化率增大 | B. | S不变,K变大,SO2转化率减小 | ||
| C. | S变小,K不变,O2转化率减小 | D. | S增大,K不变,SO2转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醇 | B. | 醚 | C. | 醛 | D. | 羧酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com