
【题目】C14H10O4常用的油脂、蜡的漂白剂、化妆品助剂、橡胶硫化剂。下面是以物质A为原料合成C14H10O4的流程:
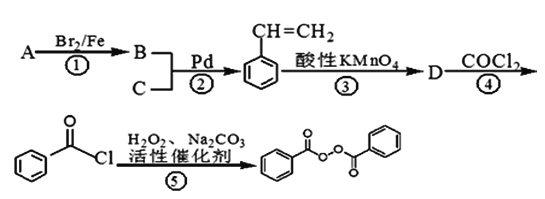
提示:①2010年赫克、根岸英一和铃木章因在“钯催化交叉偶联反应”研究领域作出了杰出贡献,而获得了诺贝尔化学奖,其反应机理可简单表示为: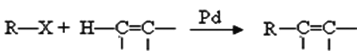
②苯乙烯和甲苯与酸性KMnO4溶液反应产物相同。
请回答下列问题:
(1)物质A的分子式为_________,物质C中含有的官能团的名称为________,D的结构简式为___________;
(2)反应①~④中属于取代反应的有________________;
(3)反应②的化学反应方程式___________________________________;
(4)某物质E为漂白剂(C14H10O4,)的同分异构体,同时符合下列条件的E的同分异构体有___种;
①含有联苯结构单元(![]() ),在一定条件下能发生银镜反应,且1molE最多可消耗4mol NaOH
),在一定条件下能发生银镜反应,且1molE最多可消耗4mol NaOH
②遇FeCl3溶液不显紫色,且苯环上核磁共振氢谱有六个吸收峰.
(5)请写出以苯乙烯和乙烯为原料,合成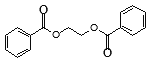 的流程,无机物任选,注明反应条件_____________。
的流程,无机物任选,注明反应条件_____________。
示例如下: 。
。
【答案】 C6H6 碳碳双键 ![]() ①②④
①②④ 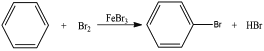 、
、![]() 6
6 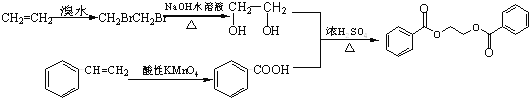
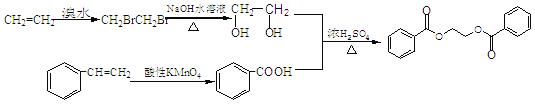
【解析】试题分析:(1)B和C发生“钯催化交叉偶联反应”生成苯乙烯,再结合A→B生成的是苯的溴代反应,可知A为苯,B为溴苯,C为乙烯,分子内含有碳碳双键;苯乙烯和甲苯与酸性KMnO4溶液反应产物相同,都是苯甲酸;
(2)反应①②④属于取代反应,③属于氧化反应;
(3)B和C发生“钯催化交叉偶联反应”生成苯乙烯,反应的化学方程式为![]() ;
;
(4)能发生银镜反应说明有醛基,遇FeCl3溶液不显紫色说明不含有酚羟基,另外苯环上核磁共振氢谱有六个吸收峰,可考虑结构的对称性,E的分子式为C14H10O4,去掉联苯12个碳原子,可考虑有2个醛基,即:2个HCOO-,可考虑在同一苯环上和不同苯环上,结合苯环上等效氢为6种,最终可知共有6种同分异构体。
(5)产物为二苯甲酸二乙酯,即用苯甲酸和乙二醇酯化就可得到,故用乙烯与溴水加成再水解可得到乙二醇,苯乙烯直接用酸性高锰酸钾氧化就可等到苯甲酸,然后二者酯化就可以了,具体流程为:


科目:高中化学 来源: 题型:
【题目】t℃时,某NaOH稀溶液中c(H+)=10a mol/L,c(OH)=10b mol/L,已知a+b=12,请回答下列问题:
(1)该温度下水的离子积常数KW=__________________。
(2)NaOH的物质的量浓度为_________________,由水电离出的c(OH)为______________。
(3)给该NaOH溶液降温,pH________(填“变大”、“变小”或“不变”)。
(4)该温度下,将pH=3的H2SO4与pH=11的NaOH等体积混合,则混合后溶液的pH=____(已知lg2=0.3) (忽略溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,某容器中充入N2和H2合成NH3,以下叙述错误的是( )
A.开始反应时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后减小为零
C.随着反应的进行,逆反应速率逐渐增大,最后保持恒定
D.随着反应的进行,正反应速率逐渐减小,最后与逆反应速率相等且都保持恒定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示
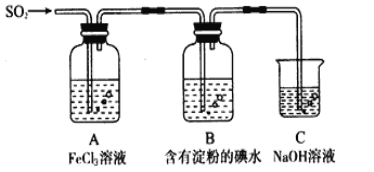
请按要求回答下列问题
(1)下列实验方案适用于在实验室制取所需SO2的是_______。
A. Na2SO3溶液与HNO3 B. Na2SO3固体与浓硫酸
C. 固体硫在纯氧中燃烧 D.铜与热浓硫酸
(2)装置C的作用是____________。如果有560mL SO2气体(已折算为标态)进入C装置中,则C中50mL NaOH溶液的物质的量浓度至少为____________mol/L才能达到目的。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、________、洗涤、自然干燥。在这一系列操作中没有用到的仪器有(填序号)____。
A.蒸发皿 B.分液漏斗 C.漏斗 D.玻璃棒 E.冷凝管
(4)在上述装置中通入过量的SO2,请设计实验验证SO2与Fe3+发生了氧化还原反应________________。
(5)本实验中能表明SO2的还原性比I-的还原性强的现象是__________________,其反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代宋应星著的《天工开物》中有关于“火法”冶炼锌的工艺记载:“炉甘石(主要成分为碳酸锌)十斤,装载入一泥罐内,……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”则下列说法不正确的是
A. 该冶炼锌的反应中包含有氧化还原反应
B. 上述高温煅烧时实质是CO还原ZnO
C. 古人把锌称倭铅是因为锌和铅的化学性质相同
D. 冶炼 Zn 的总反应方程式为: 2ZnCO3+C![]() 2Zn+3CO2↑
2Zn+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,将1.0L c molL-1CH3COOH溶液与0.1molNaOH固体混合,使之充分反应。然后向该混合溶液中加入少量CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述错误的是

A. 水的电离程度:c>b>a
B. a点对应的混合溶液中,c(CH3COOH)>c(Na+ )>c(OH-)
C. 当混合溶液呈中性时,c(Na+ )=c(CH3COO-)>c(H+) =c(OH-)
D. 该温度下,醋酸的电离平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,判断下列说法错误的是 ( )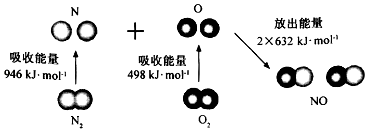
A.直观看,该反应中反应物所具有的总能量低于生成物所具有的总能量
B.2 mol气态氧原子结合生成O2(g)时,能放出498 KJ能量
C.断裂1 mol NO分子中的化学键,需要吸收632KJ能量
D.该反应的热化学方程式为:N2+O2═2NO△H=+180KJ/mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空:
(1)![]() H、
H、 ![]() H、
H、 ![]() H互为 , 16O2、18O3互为 . A.同位素 B.相同物质
H互为 , 16O2、18O3互为 . A.同位素 B.相同物质
C.同素异形体 D.同分异构体
(2)写出下列物质的电子式: ①MgCl2; ②NaOH;
(3)写出下列物质的结构式: ①C2H2; ②H2O;
(4)已知拆开1mol H﹣H键、1mol N﹣H键、1mol N≡N键分别需要的能量是436KJ、391KJ、946KJ,则N2与H2反应生成NH3的热化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com