
【题目】下列有关常见金属的说法错误的是
A.电解饱和食盐水可以获得金属钠
B.镁因在空气中形成了一薄层致密的氧化膜,故镁不需要像钠似的进行特殊保护
C.铝罐、铁罐可以盛装冷的浓硫酸、浓硝酸
D.铁、铜都是具有可变化合价的过渡元素
科目:高中化学 来源: 题型:
【题目】下列生活中的化学现象与氧化还原知识有关的是( )
A. 用食醋可以洗水垢[主要成分为CaCO3、Mg(OH)2]
B. 蔗糖放在水中片刻后消失了
C. 菜刀洗过后如果没擦干放置一段时间就会出现斑点
D. 稀盐酸洒在大理石台面上产生大量气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解
D. a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.双键、叁键都有π键
B.成键原子间原子轨道重叠越多,共价键越牢固
C.因每个原子未成对电子数是一定的,故配对原子个数也一定
D.所有原子轨道在空间都有自己的方向性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
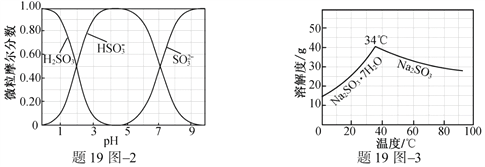
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. A、B、C、D、E均为中学化学常见的纯净物,B为最常见的液体,它们之间有如下反应关系:
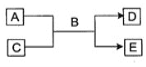
(1)若A为短周期的金属单质,D为气态单质,0.1 mol/L-1 C溶液的pH=13,则该反应的离子方程式为____________。
(2)若A的水溶液能使淀粉溶液变蓝,C为非金属氧化物,且能使品红溶液褪色,则该反应的化学方程式为___________。
(3)若A、C、D、E均为化合物,E为白色絮状沉淀,且A、C、E均含有同一种元素,则该反应的离子方程式为 ___________。
Ⅱ.(1)二氧化氯是目前国际上公认的第四代高效、无毒的光谱消毒剂,它可由KClO3和H2SO4存在下与Na2SO3反应制得。请写出该反应的离子反应方程式: ___________。
(2)过碳酸钠是一种有多种用途的新型氧系固定漂白剂,化学式可表示为Na2CO33H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了还原反应的是_________。
A. MnO2 B. KMnO4溶液 C. 稀盐酸 D. Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室以含铁的铜屑为原料制备Cu(NO3)2·3H2O晶体,并进一步探究用SOCl2制备少量无水Cu(NO3)2。设计的合成路线如下:
![]()
已知:Cu (NO3)2·3H2O ![]() Cu(NO3)2·Cu(OH)2
Cu(NO3)2·Cu(OH)2 ![]() CuO
CuO
SOCl2熔点 -105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。 请回答:
(1)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是_______。
(2)第④步中发生反应的化学方程式是_____________。
(3)第④步,某同学设计的实验装置示意图(夹持及控温装置省略,如图1有一处不合理,请提出改进方案并说明理由_______________。

(4)为测定无水Cu(NO3)2产品的纯度,可用分光光度法。
已知:4NH3·H2O + Cu2+ == Cu(NH3)42+ + 4H2O;Cu(NH3)42+ 对特定波长光的吸收程度(用吸光度A表示)与Cu2+ 在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与Cu2+ 标准溶液浓度关系如图2所示:准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100 mL,准确移取该溶液10.00mL,加过量NH3 ·H2O,再用蒸馏水定容至100 mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是_________(以质量分数表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述,正确的一项是
A.离子化合物中一定含有离子键
B.单质分子中均不存在化学键
C.含有极性键的分子一定是极性分子
D.含有共价键的化合物一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com