
分析 (1)二氧化硫具有漂白性,能使品红褪色,加热恢复红色;
(2)验证SO2的还原性,可利用溴水,发生Br2+2H2O+SO2=H2SO4+2HBr;
(3)说明SO2的氧化性,可利用H2S,二者发生氧化还原反应生成S;
(4)防止多余的SO2气体污染环境,可选择碱溶液尾气处理.
解答 解:(1)二氧化硫具有漂白性,能使品红褪色,加热恢复红色,则验证SO2的漂白作用,应将SO2气体通入③中,观察到的现象是品红试液褪色,
故答案为:③;品红试液褪色;
(2)验证SO2的还原性,可利用溴水,发生Br2+2H2O+SO2=H2SO4+2HBr,则验证SO2的还原性,应将SO2气体通入①中,观察到的现象是溴水的橙色褪去,
故答案为:①;溴水的橙色褪去;
(3)说明SO2的氧化性,可利用H2S,二者发生氧化还原反应生成S,发生的反应为SO2+2H2S=3S↓+2H2O,故答案为:SO2+2H2S=3S↓+2H2O;
(4)防止多余的SO2气体污染环境,可选择碱溶液尾气处理,则将尾气通入⑥中,反应离子方程式为SO2+2OH-=SO32-+H2O,
故答案为:⑥;SO2+2OH-=SO32-+H2O.
点评 本题考查二氧化硫的性质实验,为高频考点,把握二氧化硫的漂白性、氧化性、还原性及发生的反应为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解质不一定能导电 | |
| B. | 氨溶于水得到的氨水能导电,所以氨水是电解质 | |
| C. | 将硫酸钡放入水中不能导电,所以硫酸钡是非电解质 | |
| D. | 在水溶液或熔融状态下能导电的物质叫做电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
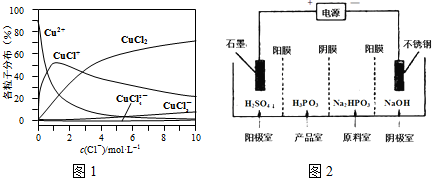
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 现用0.02500mol/L的标准盐酸溶液滴定某未知浓度的氢氧化钠溶液,有关数据记录如表:
现用0.02500mol/L的标准盐酸溶液滴定某未知浓度的氢氧化钠溶液,有关数据记录如表:| 序号 | 待测液体积(ml) | 所消耗标准盐酸的体积(ml) | ||
| 滴定前 | 滴定后 | 消耗体积 | ||
| 1 | 25.00 | 1.00 | 27.30 | 26.30 |
| 2 | 25.00 | ? | ? | ? |
| 3 | 25.00 | 1.50 | 27.84 | 26.34 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
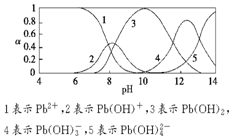 水体中重金属铅的污染问题备受关注.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(微溶)、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示.
水体中重金属铅的污染问题备受关注.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(微溶)、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
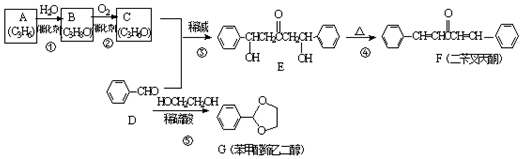
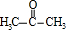 ;A加聚产物的结构简式是
;A加聚产物的结构简式是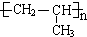 .
.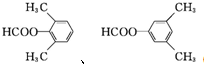 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
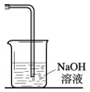 实验室常用以下方法制取氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答
实验室常用以下方法制取氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com