
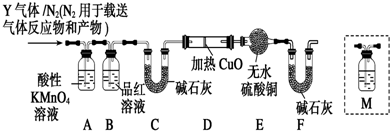
分析 (1)依据浓硫酸的强氧化性解答;
(2)①二价铁离子具有强的还原性,能够使酸性的高锰酸钾褪色,检验Fe2+,可利用+2价亚铁离子能使酸化的高锰酸钾褪色来检验;
②生成的SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,利用硫元素的守恒,结合关系式:SO2→BaSO4求出SO2的体积分数;
(3)二氧化硫能使品红溶液褪色,从而检验二氧化硫是否除尽;
(4)加热条件下,C和浓硫酸反应生成二氧化碳;
(5)在确定不存在二氧化硫条件下,将气体通入澄清石灰水检验是否含有二氧化碳;
(6)氢气具有还原性,能还原性,能还原黑色的氧化铜生成红色的铜单质,同时生成水,水能使无水硫酸铜变蓝色.
解答 解:(1)因为在常温下,铁与冷浓硫酸发生钝化反应,铁的表面覆盖一层致密的氧化膜,所以将钝化的铁钉放入硫酸铜溶液中,无明显现象,
故答案为:常温下浓硫酸使铁钝化;
(2)①a.因为含有铁离子,若选择KSCN溶液和氯水,则铁离子的存在对亚铁离子的检验带来干扰,所以不能选择KSCN溶液和氯水来检验,故a错误;
b.氢氧化钠与亚铁离子、铁离子均反应生成沉淀,且氢氧化铁为红褐色沉淀,所以不能判断氢氧化亚铁沉淀的存在,不能检验亚铁离子,故b错误;
c.亚铁离子和浓氨水反应生成白色沉淀,但不稳定,立即转化为黄绿色最终转化为红褐色沉淀,铁离子和浓氨水反应生成红褐色沉淀,所以无论是否含有亚铁离子,加入浓氨水都产生红褐色沉淀,故c错误;
d.二价铁离子具有强的还原性,能够使酸性的高锰酸钾褪色,三价铁离子不具有还原性,不能使高锰酸钾褪色,所以可以用来检验二价铁离子,故d正确;
故答案为:d;
②SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,
n(混合气体)=$\frac{0.336L}{22.4L/mol}$=0.015mol,
SO2 →BaSO4
1mol 233g
n 2.33g
n=0.01mol;
则 SO2的体积分数:$\frac{0.01mol}{0.15mol}$×100%=66.7%,
故答案为:66.7%;
(3)A除去二氧化硫,二氧化硫能使品红溶液褪色,所以B可以检验A中是否完全除去二氧化硫,
故答案为:检验SO2是否除尽;
(4)加热条件下,C和浓硫酸反应生成二氧化碳,所以Q是二氧化碳,反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(5)实验室用澄清石灰水检验二氧化碳,但二氧化硫也能使澄清石灰水变浑浊,要检验二氧化碳应该排除二氧化硫的干扰,所以在确定不存在二氧化硫条件下,将气体通入澄清石灰水检验是否含有二氧化碳,该检验装置应该在B-C之间,
故答案为:c;
(6)若Y中含有氢气,则氢气与氧化铜反应生成水和Cu,水可以用无水硫酸铜固体来检验,则看到的现象是D中固体由黑变红和E中固体变蓝,
故答案为:D中黑色粉末变红,E中白色粉末变蓝.
点评 本题通过元素化合物知识考查了性质实验方案设计方法,题目难度中等,熟悉相关物质的性质是解题关键,注意二价铁离子、三价铁离子的检验方法,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
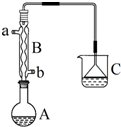 正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料.在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷.制备时的化学反应方程式及有关数据如下:
正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料.在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷.制备时的化学反应方程式及有关数据如下:| 物质 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中溶解性 |
| 正丁醇 | 74 | 0.80 | 117.3 | 微溶 |
| 正溴丁烷 | 137 | 1.27 | 101.6 | 难溶 |
| 溴化氢 | 81 | --- | --- | 极易溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 | |
| B. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA | |
| C. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数为0.2NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1molC2H4所含的电子数为12 NA | |
| B. | 标准状况下,16g甲烷中共价键数目为4NA | |
| C. | 常温常压,4 g氦气所含的核外电子数为4NA | |
| D. | 标准状况下,22.4L NO 与11.2L O2 充分反应后,所得的气体分子数一定为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
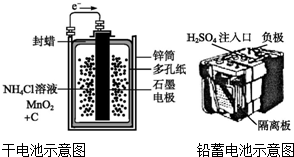
| A. | 上述电池分别属于一次电池、二次电池 | |
| B. | 干电池在长时间使用后,锌筒被破坏 | |
| C. | 铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207 g | |
| D. | 铅蓄电池负极材料为Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
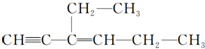 分子中处于四面体结构中心的碳原子数为a,一定处在同一平面内的碳原子数为b,一定处在同一直线上的碳原子数为c,则a、b、c依次为( )
分子中处于四面体结构中心的碳原子数为a,一定处在同一平面内的碳原子数为b,一定处在同一直线上的碳原子数为c,则a、b、c依次为( )| A. | 4、5、3 | B. | 4、6、3 | C. | 2、4、5 | D. | 4、4、6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com