
| A. | 氢氧化亚铁 | B. | 过氧化钠 | C. | 镁条 | D. | 氯水 |
科目:高中化学 来源: 题型:选择题
| A. | 将pH=4的醋酸溶液稀释后,H+浓度增大 | |
| B. | 常温下,0.01L pH=10的NaOH溶液加水稀释到10L,此时溶液的pH=7 | |
| C. | 改变条件使醋酸的电离平衡向右移动,醋酸的电离度一定增大 | |
| D. | 常温下0.1mol•L-1醋酸溶液的pH=a,加入适量的醋酸钠固体能使溶液pH=(a+1) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
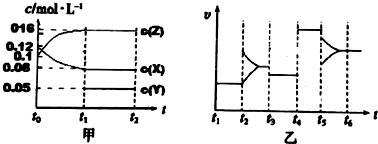
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
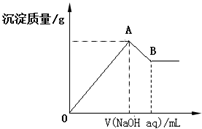
| A. | x=$\frac{3a}{5-a}$ | |
| B. | x的取值范围是0<x<$\frac{11}{32}$ | |
| C. | A点横坐标的值不随x发生变化 | |
| D. | 若B点横坐标为200mL时,c(NaOH)=7.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
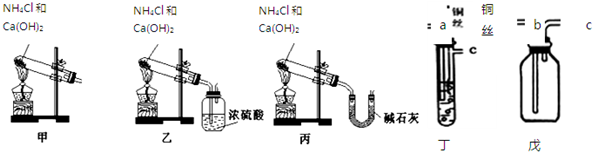
 2NH3.
2NH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
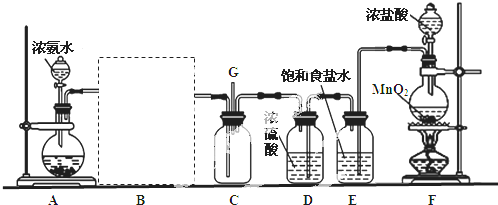
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该混合粉末从组成看,其成分皆是碱性氧化物 | |
| B. | 溶液Y 中2n(Mg2+)<n(Cl-)<3n(Fe3+) | |
| C. | 沉淀X的成分为二氧化硅 | |
| D. | 在溶液Y 中加入过量的氨水,过滤得到的沉淀的成分是氢氧化铁和氢氧化镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com