
| A. | 图 n(O2)=2mol时,高温下C和O2在密闭容器中的反应产物 n(O2)=2mol时,高温下C和O2在密闭容器中的反应产物 | |
| B. | 图 n(NaOH)=1mol 时,CO2和NaOH溶液反应生成的盐 n(NaOH)=1mol 时,CO2和NaOH溶液反应生成的盐 | |
| C. |  n(HCl)=1mol 时,K2CO3和HCl溶液在敞口容器反应生成的气体 n(HCl)=1mol 时,K2CO3和HCl溶液在敞口容器反应生成的气体 | |
| D. |  n(HNO3)=2mol 时,Fe和稀硝酸反应生成的氧化产物(还原产物为NO) n(HNO3)=2mol 时,Fe和稀硝酸反应生成的氧化产物(还原产物为NO) |
分析 A.C和O2在密闭容器中,发生C+O2 $\frac{\underline{\;高温\;}}{\;}$CO2、CO2+C $\frac{\underline{\;高温\;}}{\;}$2CO;
B.CO2逐步通入到NaOH溶液中,发生CO2+2NaOH═Na2CO3+H2O、Na2CO3+H2O+CO2═2NaHCO3;
C.K2CO3逐步加入到HCl溶液中,发生K2CO3+2HCl═2KCl+H2O+CO2↑;
D.Fe和稀HNO3反应时,铁少量时发生Fe+4HNO3═Fe(NO3)3+NO↑+H2O,全部转化为三价铁后继续加人铁,则发生Fe+2Fe(NO3)3═3Fe(NO3)2.
解答 解:A.因开始氧气过量,则发生C+O2$\frac{\underline{\;高温\;}}{\;}$CO2,n(O2)=2mol,生成二氧化碳为2mol,然后发生CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO,则生成4molCO,图象与反应不相符合,故A错误;
B.因开始碱过量,则发生CO2+2NaOH═Na2CO3+H2O,n(NaOH)=1mol时生成0.5molNa2CO3,再加人二氧化碳发生Na2CO3+H2O+CO2═2NaHCO3,则最终碳酸钠减少为0,碳酸氢钠生成1mol,图象与反应不符,故B错误;
C.因开始反应时盐酸过量,则发生K2CO3+2HCl═2KCl+H2O+CO2↑,n(HCl)=1mol时生成0.5mol二氧化碳后再加0.5mol的碳酸钾恰好完全反应,图象与反应相符,故C正确;
D.因开始硝酸过量,则发生Fe+4HNO3═Fe(NO3)3+NO↑+H2O,n(HNO3)=2mol时生成0.5molFe(NO3)3,图象与反应不相符,故D错误;
故选C.
点评 本题较难,考查化学反应与图象的关系,明确图象中的线、点的意义及对应的化学反应是解答本题的关键,并明确反应物的量对反应的影响来分析反应的产物.


科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 单质、氧化物、酸、碱和盐的相互关系,可以用图简单表示,限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化学方程式表示(所写化学方程式不得重复).
单质、氧化物、酸、碱和盐的相互关系,可以用图简单表示,限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化学方程式表示(所写化学方程式不得重复).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸鉴别浓硫酸与浓硝酸 | |
| B. | 用淀粉碘化钾溶液区分二氧化氮和二氧化碳 | |
| C. | 用酸性高锰酸钾溶液除去二氧化碳中混有的少量二氧化硫 | |
| D. | 常温下用铜片和浓HNO3反应制取二氧化氮气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

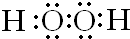 ,C元素在周期表中的位置是第二周期、第ⅦA族.
,C元素在周期表中的位置是第二周期、第ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷、丁烯 | B. | 乙炔、丙烷 | C. | 乙烷、乙烯 | D. | 乙炔、乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com