

分析 (1)镁合金具有硬度大、密度小、散热性好、抗震性好等优点;
(2)Al与NaOH溶液反应,而Mg不能,由图可知,200mL~240mL发生Al(0H)3+NaOH=NaAlO2+2H2O,生成0.15molMg(OH)2和(0.35mol-0.15mol)Al(0H)3,结合原子守恒及反应计算;
(3)Mg17Al12+17H2=17MgH2+12Al,得到的混合物在6.0mol/LHCl溶液中能完全释放出H2,则Mg17Al12+70HCl=17MgCl2+12AlCl3+35H2↑,以此计算;
(4)Al-空气燃料电池以NaCl溶液为电解质溶液,正极上氧气得到电子;以KOH溶液为电解质溶液,电池反应为Al、氧气、KOH反应生成偏铝酸钾和水.
解答 解:(1)镁合金具有硬度大、密度小、散热性好、抗震性好等优点,
故答案为:硬度大、密度小、散热性好、抗震性好;
(2)Al与NaOH溶液反应,而Mg不能,则合金溶于NaOH溶液发生的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,由图可知,生成0.15molMg(OH)2和(0.35mol-0.15mol)Al(0H)3,由Al原子守恒可知,n(Al)=0.2mol,其质量为0.2mol×27g/mol=5.4g,由200mL~240mL发生Al(0H)3+NaOH=NaAlO2+2H2O,消耗n(NaOH)=0.2mol,所以c(NaOH)=$\frac{0.2mol}{0.04L}$=5mol/L,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;5.4;5;
(3)由Mg17Al12+17H2=17MgH2+12Al,得到的混合物在6.0mol/LHCl溶液中能完全释放出H2,则Mg17Al12+70HCl=17MgCl2+12AlCl3+35H2↑,
所以1mol Mg17A112完全吸氢后得到的混合物与上述盐酸完全反应,释放出H2的物质的量为35mol+17mol=52mol,
故答案为:52mol;
(4)Al-空气燃料电池以NaCl溶液为电解质溶液,正极上氧气得到电子,正极反应为O2+2H2O+4e-=4OH-;以KOH溶液为电解质溶液,电池反应为Al、氧气、KOH反应生成偏铝酸钾和水,该电池反应为4Al+3O2+4KOH=4KAlO2+2H2O,
故答案为:O2+2H2O+4e-=4OH-;4Al+3O2+4KOH=4KAlO2+2H2O.
点评 本题考查较综合,涉及Al的化学性质、反应方程式及图象的计算及电化学,③为解答的易错点,注重高考高频考点的考查,较好的体现学生双基和计算能力、图象分析能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .则:
.则: .
.| A→H | A→B | B→C | F→G | |
| 反应类型 |

 +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$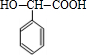 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 3:1 | C. | 3:2 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol•L-1 | B. | 1.0 mol•L-1 | C. | 1.5 mol•L-1 | D. | 2.0 mol•L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com