
今有如下三个热化学方程式:
H2(g)+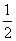 O2(g)===H2O(g) ΔH=a kJ·mol-1
O2(g)===H2O(g) ΔH=a kJ·mol-1
H2(g)+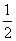 O2(g)===H2O(l) ΔH=b kJ·mol-1
O2(g)===H2O(l) ΔH=b kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH=c kJ·mol-1
下列关于他们的表述正确的是( )
A.它们都是吸热反应 B.a、b和c均为正值
C.a=b D.2b=c
科目:高中化学 来源: 题型:
下列关于碱金属的叙述中 ,正确的是
,正确的是 ()
()
| A. | 碱金属都可以保存在煤油中 | |
| B. | 碱金属与水 | |
| C. | 碱金属在空气中加热均可生成多种氧化物 | |
| D. | 碱金属的硬度小、密度小、熔点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
(1)H2(g)+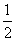 O2(g)===H2O(g) ΔH1=a kJ·mol-1
O2(g)===H2O(g) ΔH1=a kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g) ΔH2=b kJ·mol-1
(3)H2(g)+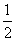 O2(g)===H2O(l) ΔH3=c kJ·mol-1
O2(g)===H2O(l) ΔH3=c kJ·mol-1
(4)2H2(g)+O2(g)===2H2O(l) ΔH4=d kJ·mol-1
下列关系式中正确的是( )
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式书写正确的是( )
A.2SO2+O2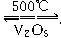 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+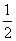 O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)===CO2(g) ΔH=+393.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
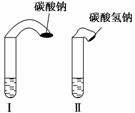
(1) 高中教材中有这样一个实验:在两支试管中分别加入3 mL稀盐酸(均足量)(只有浓度
小于1 mol·L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3 g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
①试管中(填产生沉淀或气体及反应速率等相关现象)_____________________________ ________________________________________________________________________
________________________________________________________________________;
②试管中气球大小(包含试管)体积之比约为(填最简单整数比)Ⅰ∶Ⅱ=________;
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变凉,而盛Na2CO3粉末的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。
甲得出的结论是否正确________(填“正确”或“不正确”)。
(2)为研究是吸热反应还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):(注:每组固体全溶解且完全反应)
| 序号 | 试剂1 | 试剂2 | 混合前 温度 | 混合后最高或 最低温度 |
| A | 50 mL水 | 2.5 g NaHCO3固体 | 20℃ | 18.5℃ |
| B | 50 mL水 | 3.2 g Na2CO3固体 | 20℃ | 23.3℃ |
| C | 50 mL稀盐酸 | 2.5 g NaHCO3固体 | 20℃ | 17.4℃ |
| D | 50 mL稀盐酸 | 3.2 g Na2CO3固体 | 20℃ | 24.4℃ |
请你帮助填写相关内容:
① 该研究报告的题目是_________________________________________________
________________________________________________________________________;
②该实验中所用的仪器除试管、药匙(或V形纸槽)、气球、下端带环状玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为______________和________________;
③通过上述实验可得出两条结论:
a.Na2CO3溶液和盐酸的反应是______(吸热或放热)反应;
b.NaHCO3溶液和盐酸的反应是______(吸热或放热)反应。
答案 (1)①两支试管中都产生大量气泡,但盛NaHCO3的试管中反应速率要快得多
②42∶53
③不正确
(2)①《NaHCO3、Na2CO3和盐酸反应过程中热效应的研究》
②托盘天平 温度计
③a.放热 b.吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
 (2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
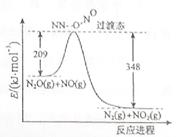
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2, 其△H= kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
黄曲霉毒素M1是一种具有强致癌性的有机物,其分子结构如图所示。下列有关黄曲霉毒素M1的说法正确的是( )
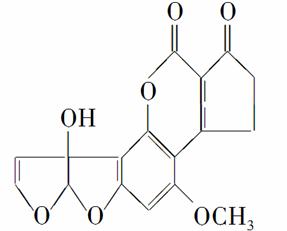
A.黄曲霉毒素M1的分子式为C17H14O7
B.黄曲霉毒素M1含有羟基,此羟基能被催化氧化为醛基
C.1 mol黄曲霉毒素M1与NaOH溶液发生反应最多能消耗2 mol NaOH
D.1 mol黄曲霉毒素M1最多能 与7 mol H2发生加成反应
与7 mol H2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com