
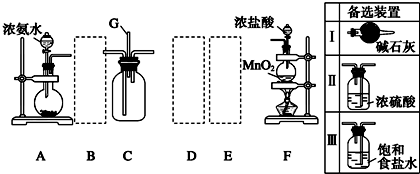
分析 ①根据装置可知,A中用浓氨水与碱石灰制氨气,碱石灰吸收氨水中的水,同时放热使氨气挥发出来;
②根据杂质的性质选择除杂装置;
③氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,由此写出反应方程式;
④从装置C的出气管口处逸出的有色气体应为氯气,吸收氯气用氢氧化钠溶液,根据电荷守恒和元素守恒书写离子方程式.
解答 解:①根据装置可知,A中用浓氨水与碱石灰制氨气,碱石灰吸收氨水中的水,同时放热使氨气挥发出来,反应方程式可表示为NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
②氨气中混有水蒸气,氨气是碱性气体,要除去水蒸气只能用碱性物质,故B选Ⅰ;制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和 水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢E应选Ⅲ;水蒸气常用浓硫酸除去,故D选Ⅱ.
故答案为:Ⅰ、Ⅱ、Ⅲ.
③氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气8NH3+3C12=6NH4C1+N2,
故答案为:8NH3+3C12=6NH4C1+N2;
④从装置C的出气管口处逸出的有色气体应为氯气,吸收氯气用氢氧化钠溶液,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查了氯气、氨气的实验室制备及性质检验,把握实验装置的作用、物质的性质为解答的关键,题目难度中等.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:解答题
 煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.
煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃、水晶、陶瓷的主要成分均是硅酸盐 | |
| B. | SO2可以使溴水褪色,所以SO2具有漂白性 | |
| C. | 将浓氨水滴到氢氧化钠固体中可以制取氨气 | |
| D. | NaHCO3能与碱反应,因此食品工业上用作焙制糕点的膨松剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应速率降低 | B. | 平衡向右移动 | C. | B的转化率提高 | D. | a+b<c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取LKSCN溶液,向试管中滴入1~2滴0.1mol/LKSCN溶液 | (1)若出现红色,则假设1成立; (2)若未出现红色,则假设2或假设3成立. |
步骤2:另取2~3mL样品溶液于试管中滴入1~2mL品红稀溶液 | 1若品红溶液红色褪色,假设2成立; 2若品红溶液不褪色,结合步骤1中的(2)则假设3成立 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:填空题
用Cl2生产某些含氯有机物时会产生副产物HC1。利用 反应A,可实现氯的循环利用。
反应A,可实现氯的循环利用。
反应A:4HCl+O22Cl2+2H2O
(1)已知:Ⅰ、反应A中, 4mol HCl被氧化,放出115.6kJ的热量。
4mol HCl被氧化,放出115.6kJ的热量。
Ⅱ、
①反应A的热化学方程式是________________________。
②断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________kJ,H2O中H—0 键比HCl中H—Cl键(填“强”或“弱”)_______________。
(2)合成氨工厂常通过测定反应前后混合气体的密度来确定氨的转化率。某工厂测得合成塔中N2、H2混合气体的密度为0.5536g/L(标准状况),从合成塔中出来的混合气体在相同条件下密度为0.693g/L(标准状况)。该合成氨厂N2的转化率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 生成等量的CuSO4时,②消耗的酸最少,且能体现绿色化学思想 | |
| B. | 反应⑥中Y可以是葡萄糖或乙醛溶液 | |
| C. | 反应④所得混合气体X中一定有O2 | |
| D. | 反应①中H2SO4与HNO3物质的量最佳比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com