
下列有关说法正确的是( )
|
| A. | 将0.2mol/L的NH3•H2O与0.1mol/L的HCl溶液等体积混合后PH>7,则c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+) |
|
| B. | 已知MgCO3的Ksp=6.82×10﹣6,则所有含有固体MgCO3的溶液中,都有C(Mg2+)=C(CO32﹣),且C(Mg2+)•C(CO32﹣)═6.82×10﹣6 mol•L﹣1 |
|
| C. | 0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合: c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3) |
|
| D. | 用惰性电极电解Na2SO4溶液,阳阴两极产物的物质的量之比为2:1 |
| 酸碱混合时的定性判断及有关ph的计算;难溶电解质的溶解平衡及沉淀转化的本质.. | |
| 专题: | 电离平衡与溶液的pH专题. |
| 分析: | A、依据电荷守恒判断; B、所有含有固体MgCO3的溶液中,c(Mg2+)、c(CO32﹣)的浓度不一定相等; C、依据物料守恒分析; D、用惰性电极电解Na2SO4溶液,阳阴两极产物分别为氧气和氢气. |
| 解答: | 解:A、若c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+),则溶液中阴离子所带负电荷大于阳离子所带正电荷,不符合电荷守恒,故A错误; B、Ksp与温度有关,Ksp=c(Mg2+)•c(CO32﹣)=6.82×10﹣6成立,当含有其他镁离子或碳酸根离子的混合溶液中,不一定存在碳酸根离子浓度和镁离子浓度相同,故B错误; C、据物料守恒,溶液中存在c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3),NaHCO3溶液中存在c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3),所以相同浓度的碳酸钠和碳酸氢钠溶液中c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3),故C正确; D、用惰性电极电解Na2SO4溶液,阳阴两极产物分别为氧气和氢气,其物质的量之比为1:2,故D错误; 故选C. |
| 点评: | 本题考查了电荷守恒、物料守恒、沉淀的溶度积以及电解的相关知识,题目跨度大,难度中等. |


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
下列有关电解原理的说法正确的是( )
①电解是把电能转变成化学能;
②电解是把化学能转变为电能;
③电解质溶液的导电是化学变化,金属的导电是物理变化;
④不能自发进行的氧化还原反应,通过电解原理可以实现;
⑤任何溶液被电解时必然会导致氧化还原反应的发生
A.①②③④ B.②③⑤
C.③④ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应的反应过程和能量变化如图所示,下列有关该反应的叙述
正确的是( )
A. 该反应是吸热反应
B. 反应物的总能量低于生成物的总能量
C. 该反应的反应热△H < 0
D. 加入催化剂后反应放出的热会减少
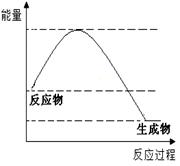
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定溶液中关于离子共存的说法正确的是( )
|
| A. | 25℃时溶液中一定大量共存:Na+、Ca2+、Cl﹣、SO42﹣ |
|
| B. | 能与铝反应放出氢气的溶液中一定共存:Mg2+、Cu2+、SO42﹣、NO3﹣ |
|
| C. | 弱碱性溶液中可能大量共存:Na+、K+、Cl‾、HCO3‾ |
|
| D. | 0.1mol/LFeCl3溶液中可能大量共存:Fe2+、NH4+、SCN﹣、SO42﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 |
|
| A | 浓盐酸 | MnO2 | NaOH | 制氯气并吸收尾气 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应实验,能达到实验目的的是
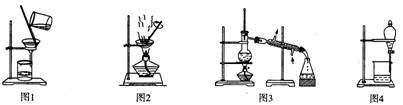
A.用图1所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒
B.用图2所示装置蒸发掉CuCl2溶液中部分水制得CuCl2·2H20晶体
C.用图3所示装置从CH3OH与C2H5OH的混合物中分离出乙醇
D.用图4所示装置从C2H5OH与C2H5OOCCH3的混合物中分离出乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有的溶质是FeBr2、Fel2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是
①原溶液中的Br一一定被氧化
②通入氯气之后原溶液中的Fe2+一定有部分或全部被氧化
③不能确定通入氯气后的溶液中是否存在Fe2+
④若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgN03溶液,只产生白色沉淀,说明原溶液中的I一、Fe2+、Br一均被完全氧化
A.①②③ B.②③④ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
I.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3A1F6)在熔融状态下进行电解,其阴极电极反应式为 ,其电极均由石墨材料做成,则电解时不断消耗的电极是 (填“阴极”或“阳极”),冰晶石的作用为 。
(2)铝电池性能优越,A1-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则负极的电极反应式为 ,正极附近溶液的pH (填“变大”“不变”或“变小”)。
已知:①2Al(s)+3Cl2(g)=2AlCl3(s) △H1=-1390 .8kJ/mol
②4Al(s)+3O2(g)=2Al2O3(s) △H2=-3339.6kJ/mol
③2C(s)+O2(g)=2CO(g) △H3=-221.0kJ/mol
Al2O3(s)+ 3C(s)+3Cl2(g)=2AlCl3(s)+3CO(g)的△H= 。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中的能量变化示意图,
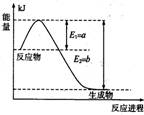
请写出合成氨的热化学反应方程式: (ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为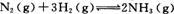 在一定温度下,
在一定温度下,
将一定量的N2和H2通入到体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
A.增大压强 B.增大反应物的浓度 C.使用催化剂 D.降低温度
Ⅲ.铁及其化合物在生活、生产中有广泛应用。请回答下列问题。
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,有3 m01FeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 m01FeS2参加反应,转移 mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式: 。
Ⅳ.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnS04溶液,如图所示
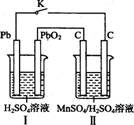
铅蓄电池的总反应方程式为 ,当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为 ,MnO2的理论产量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.含有大量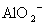 的溶液中:K+、
的溶液中:K+、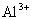 、
、 、
、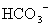 可共存
可共存
B.CO(g)的燃烧热是283.0kJ· ,则
,则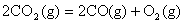 反应的
反应的
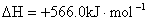
C.用NaOH溶液雕刻工艺玻璃上的纹饰
D.在某钠盐溶液中含有等物质的量的 、
、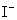 、
、 、
、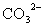 、
、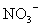 、
、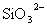 中一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有
中一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有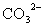
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com