
有8种物质:①甲烷;②苯;③聚乙烯;④1,3-丁二烯;⑤2-丁炔;⑥环己烷;⑦邻二甲苯;⑧环己烯。既能使酸性高锰酸钾溶液褪色又能与溴水因发生化学反应使之褪色的是 ( )
A.③④⑤⑧ B.④⑤⑦⑧ C.④⑤⑧ D.③④⑤⑦⑧
C
【解析】
试题分析:①甲烷既不能使酸性高锰酸钾溶液褪色又不能与溴水发生化学反应;②苯既不能使酸性高锰酸钾溶液褪色又不能与溴水发生化学反应;③聚乙烯既不能使酸性高锰酸钾溶液褪色又不能与溴水发生化学反应;④1,3-丁二烯既能使酸性高锰酸钾溶液褪色又能与溴水发生化学反应;⑤2-丁炔既能使酸性高锰酸钾溶液褪色又能与溴水发生化学反应;⑥环己烷既不能使酸性高锰酸钾溶液褪色又不能与溴水发生化学反应;⑦邻二甲苯能使酸性高锰酸钾溶液褪色但不能与溴水发生化学反应;⑧环己烯既能使酸性高锰酸钾溶液褪色又能与溴水发生化学反应,所以答案选C。
考点:考查对能使酸性高锰酸钾溶液褪色又能与溴水因发生化学反应使之褪色的物质结构的判断


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源:2013-2014山东省济南市高三5月针对性训练理综化学试卷(解析版) 题型:选择题
“神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料。甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料。下列说法中,错误的是
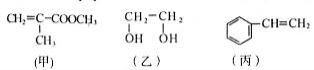
A.甲物质可以在引发剂作用下生成有机高分子化合物
B.1 mol乙物质可与2 mol钠完全反应生成1 mol氢气
C.丙物质能够使酸性高锰酸钾溶液退色
D.甲、乙、丙三种物质都可以发生加成反应
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省6月月考高一化学必修2试卷(解析版) 题型:填空题
I.乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的结构简式为____________。
(2)下列物质中,不可以通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3B.CH3CHCl2
C.CH3CH2OH D.CH3CH2Br
(3)已知 2CH3CHO+O2 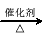 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
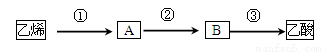
反应②的化学方程式为____________________________________。
工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为____________________________________,反应类型是__________________。
II.在实验室可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。

(1)乙醇、乙酸分子中官能团的名称分别是_________、_________。
(2)试管a中发生反应的化学方程式为
_____________________________________________,
反应类型是______________。
(3)浓H2SO4的作用是:__________________________。
反应开始前,试管b中盛放的溶液是____________。
该溶液的作用是
___________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省6月月考高一化学必修2试卷(解析版) 题型:选择题
下列反应中生成物总能量高于反应物总能量的是( )
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省兰陵县下学期期中考试高二化学试卷(解析版) 题型:选择题
有机物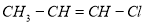 能发生的反应有 ( )
能发生的反应有 ( )
①取代反应 ②加成反应 ③ 消去反应 ④ 使溴的四氯化碳溶液褪色
⑤ 聚合反应 ⑥ 使酸性高锰酸钾溶液褪色
 A.全部 B.除⑤外 C.除①外 D.除①、⑤外
A.全部 B.除⑤外 C.除①外 D.除①、⑤外
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省兰陵县下学期期中考试高二化学试卷(解析版) 题型:选择题
分子式为C4H9Cl的同分异构体有( )
A.1种 B.2种 C.3种 D.4种
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省兰陵县下学期期中考试高一化学试卷(解析版) 题型:简答题
(12分)下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA |
| 0 | |||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
2 |
|
|
| ② | ③ | ④ |
|
|
3 | ⑤ |
| ⑥ |
|
| ⑦ | ⑧ | ⑨ |
(1)在①~⑨元素中,金属性最强的元素是 ,氧化物有两性的
元素是 。(均填元素符号)
(2)元素⑦与元素⑧相比,⑧的非金属性较强,下列表述中能证明这一事实的是
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
d.⑦的氧化物的水化物比⑧的氧化物的水化物酸性弱
设计一个简单实验,证明元素⑦与元素⑧的非金属性强弱,只写出反应的化学方程式(不写实验步骤)______________________________________
(3)⑤与⑥两元素最高价氧化物的水化物相互反应的离子方程式为 _____________________________________________________
(4)③的氢化物的电子式为__________________
(5)①④⑤三种元素形成的最简单一种化合物含有的化学键类型有
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省兰陵县下学期期中考试高一化学试卷(解析版) 题型:选择题
下列关于化学反应速率的说法中正确的是( )
A.决定化学反应速率的主要因素是温度
B.反应速率用于衡量化学反应进行快慢
C.可逆反应达到平衡状态时正逆反应的速率都为0
D.增大反应物的量或提高反应温度一定能增大反应速率
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省临沂市高三5月二模理综化学试卷(解析版) 题型:填空题
(18分)NOx、SO2是主要的大气污染物,科学处理这些污染物对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H= kJ?mol-1。
(2)利用氧化氮氧化物的流程如下:
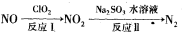
写出反应Ⅱ的化学方程式 ___________________;已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移0.5mol电子,则反应Ⅱ中可生成N2的体积
为_________L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡_________移动(填“向左”、“向右”或“不”);试计算溶液中  。
。
(常温下H2SO3的电离常数: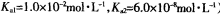 )
)
(4)利用Fe2(SO4)3溶液也可处理SO2废气,其流程如下图所示。
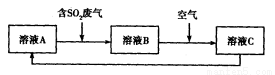
①简述用Fe2(SO4)3晶体配制溶液A的方法__________________。
②假设反应过程中溶液的体积不变,A、C两溶液的pH大小关系为:pH ___pH
___pH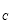 。(填
。(填
“>”、“=”或“<”)。
③设计实验验证溶液B是否仍具有处理废气的能力,简述实验的操作、现象和结论_____________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com