
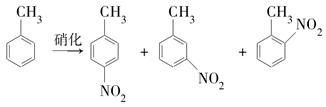
| 催化剂 |  | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
| 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | |||
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
| 1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
| NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
| 0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
| 0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
| 0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
科目:高中化学 来源:不详 题型:实验题

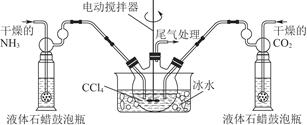
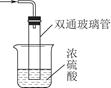
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.用此法提取镁的优点之一是原料来源丰富 |
| B.步骤⑦电解MgCl2时阴极产生氯气 |
| C.步骤⑥可将晶体置于HCl气氛中脱水 |
| D.上述工艺流程中涉及化合、分解和复分解反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

 H+ + OH-、HCO3-
H+ + OH-、HCO3- H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因: 。
H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.过滤操作时如果有必要可以用蒸馏水洗涤滤纸上的沉淀2-3次 |
| B.蒸馏操作时,应使温度计水银球插入液态混合物中 |
| C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D.萃取操作时,要不断振摇分液漏斗并放气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾淀粉试纸检验,观察试纸颜色的变化 |
| B.铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,该铝热剂不含氧化铁 |
| C.测氯水的pH可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
| D.用新制氢氧化铜悬浊液可以鉴别甲酸、甲酸甲酯、乙酸、乙酸乙酯四种物质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入_________________________________ ________________________________ | _______________________________ _______________________________ 说明沉淀中有CaCO3 |
| 步骤2:_________________________ ________________________________ | ________________________________ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| A.灼烧过程中部分氧化铜被还原 |
| B.灼烧不充分,铜未被完全氧化 |
| C.氧化铜在加热过程中分解生成铜 |
| D.该条件下铜无法被氧气氧化 |
 NaNO3+NaNO2+H2O)。
NaNO3+NaNO2+H2O)。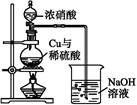
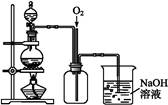
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com