
����Ŀ����1����֪NaHAˮ��Һ�ʼ��ԡ�
�������ӷ���ʽ��ʾNaHAˮ��Һ�ʼ��Ե�ԭ��__________________�������ӷ���ʽ����Ӧ��������������
����NaHAˮ��Һ�и�����Ũ�ȵĴ�С��ϵ��_______________________________
��2��ʵ����������AlCl3����Һʱ��Ϊ������AlCl3��ˮ��ɼ���������_____(��д���ʵ�����)����AlCl3��Һ���ɣ����գ����õ�����Ҫ���������________���ѧʽ����
��3�������£����ʵ���Ũ����ͬ��������Һ����NH4Cl����(NH4)2SO4����NH3��H2O����(NH4)2CO3����NH4HSO4����Һ��c(![]() )�Ӵ�С˳��Ϊ__________________(�����)��
)�Ӵ�С˳��Ϊ__________________(�����)��
��4�������£�pH=5�������pH=9������������Һ�������ϣ�����Һ��pH=_________��
��5������ʯ����Ҫ�ɷ�BaCO3(��Ca2����Mg2����Fe3��������)��ʵ�������ö���ʯ�Ʊ�BaCl2��2H2O���������£�

��֪��
Ca2+ | Mg2+ | Fe3+ | |
��ʼ����ʱ��pH | 11.9 | 9.1 | 1.9 |
��ȫ����ʱ��pH | 13.9 | 11.1 | 3.2 |
��֪��Ksp��BaC2O4��=1.6��10-7��Ksp��CaC2O4��=2.3��10-9
����NH3��H2O��pH��8�ɳ�ȥ______(�����ӷ���)���������к�________(�ѧʽ)������H2C2O4ʱӦ���������ԭ����__________________________________________��
���𰸡�HA-+H2O H2A+OH- ��HA- ��ˮ��̶ȴ��������̶� c��Na+����c��HA-����c��OH-����c��H+����c��A2-�� ���� Al2O3 �ڣ��ܢ٣��� 7 Fe3+ Mg(OH)2��Ca(OH)2 H2C2O4�����ᵼ������BaC2O4��������Ʒ��������
��������
��1����NaHAˮ��Һ�ʼ��ԣ�˵��NaHA��ǿ���������ʽ�Σ�HA-���ܵ�������ˮ�⣬��ˮ��̶ȴ��ڵ���̶ȣ�
��HA-���ܵ�������ˮ�⣬��ˮ��̶ȴ��ڵ���̶ȣ��ݴ˷�������Ũ�ȴ�С˳��
��2��AlCl3��Һˮ�������������������ᣬ��Ӧ�����ӷ���ʽΪAl3++3H2OAl(OH)3+3H+�������������������������ӵ�ˮ�⣻AlCl3��Һ���ɣ��Ȼ���ӷ����ٽ�ˮ��������еõ����������������յõ�Al2O3��
��3��������ʵĵ��������ģ��ε���������ӵ�ˮ�������ģ��ݴ˷�����
��4�������£�pH=5��������c(H+)=10-5mol/L��pH=9������������Һ��c(OH-)=10-5mol/L�����ߵ������ϣ���ǡ�÷�Ӧ�����Ȼ�����Һ��
��5����������ͼ�����������ݿ�֪������NH3��H2O����pH��8ʱ��ֻ��Fe3����ȫ��������ȥ������NaOH����pH��12.5���Աȱ��������ݿ�֪����ʱMg2����ȫ������Ca2�����ֳ����������������к�Mg(OH)2��Ca(OH)2������Ksp(BaC2O4)��1.6��10��7��H2C2O4����ʱBa2����ת��ΪBaC2O4�������Ӷ�ʹBaCl2��2H2O�IJ������١�
��1����NaHAˮ��Һ�ʼ��ԣ�˵��HA��ˮ��̶ȴ��������̶ȣ�ˮ�������������Ũ�ȴ���������Ũ�ȣ���ʹ��Һ�ʼ��ԣ�ˮ�ⷽ��ʽΪ��HA+H2OH2A+OH��
�ʴ�Ϊ��HA- + H2O H2A+OH-��HA-��ˮ��̶ȴ��������̶ȣ�
��NaHAˮ��Һ�ʼ��ԣ�˵��HA��ˮ��̶ȴ��������̶ȣ������Ӳ�ˮ�⣬��������Ũ�����HA�ĵ����ˮ�ⶼ��������Һ�ʼ��ԣ���c(OH)>c(H+)����Һ����������ˮ��HA����õ�������c(H+)>c(A2)������NaHAˮ��Һ�и�����Ũ�ȵĴ�С��ϵ��c(Na+)��c(HA-)��c(OH-)��c(H+)��c(A2-)��
�ʴ�Ϊ��c(Na+)��c(HA-)��c(OH-)��c(H+)��c(A2-)��
��2��AlCl3��Һˮ�������������������ᣬ��Ӧ�����ӷ���ʽΪAl3++3H2OAl(OH)3+3H+��ʵ����������AlCl3����Һʱ��Ϊ������AlCl3��ˮ�⣬�ɼ����������������������ӵ�ˮ�⣻AlCl3��Һ���ɣ��Ȼ���ӷ����ٽ�ˮ��������еõ����������������յõ�Al2O3��
�ʴ�Ϊ�����Al2O3��
��3��������ʵĵ��������ģ��ε���������ӵ�ˮ�������ģ������£����ʵ���Ũ����ͬ��������Һ����NH4Cl����(NH4)2SO4����NH3��H2O����(NH4)2CO3����NH4HSO4���Ȳ�����ˮ�⣬���(NH4)2SO4�͢�(NH4)2CO3����������NH4+����������NH4+��Ũ�ȴ��������������ʣ�����(NH4)2CO3��NH4+ˮ�������ԣ�CO32ˮ���Լ��ԣ�������ٽ�������NH4+ˮ������϶࣬ʣ��NH4+�������٣�����Һ��c(NH4+)�ڣ��ܣ��٢ۢ����������У���NH4HSO4������ǿ��NH4+ˮ���ܵ��������������NH4+�����϶࣬��Һ��c(NH4+)�ϴ�NH4Cl��NH4+ˮ�����NH4HSO4�Ƚϣ�ˮ��õ��ٽ�����NH4+�������٣�����Һ��c(NH4+)�ݣ��٣���NH3H2O����Һ��c(NH4+)С����ε�c(NH4+)��Ӧ��С����٣��ۣ���c(NH4+)�ɴ�С��˳������Ϊ���ڣ��ܣ��ݣ��٣��ۣ�
�ʴ�Ϊ���ڣ���>��>�٣��ۣ�
��4�������£�pH=5��������c(H+)=10-5mol/L��pH=9������������Һ��c(OH-)=10-5mol/L�����ߵ������ϣ���ǡ�÷�Ӧ�����Ȼ�����Һ������Һ��pH=7��
�ʴ�Ϊ��7��
��5����������ͼ�����������ݿ�֪��Fe3+��ȫ����ʱ��pHΪ3.2�����백ˮ����pH=8ʱ��Fe3+��ȫ����������1ΪFe(OH)3�������������Ƶ���pH=12.5��Ca2+��ȫ����ʱ��pHΪ13.9��Mg2+��ȫ����ʱ��pHΪ11.1����Mg2+��ȫ������Ca2+���ֳ������������к�Mg(OH)2��Ca(OH)2�����˺���Һ����Ҫ��Ca2+��Ba2+��Ksp(BaC2O4)=1.6��10-7��Ksp(CaC2O4)=2.3��10-9�����γ�CaC2O4����������H2C2O4ʱӦ�����������ֹCaC2O4������ȫ������H2C2O4�ᵼ������BaC2O4��������Ʒ�IJ������٣�
�ʴ�Ϊ��Fe3+��Mg(OH)2��Ca(OH)2��H2C2O4�����ᵼ������BaC2O4��������Ʒ�������١�


 53���ò�ϵ�д�
53���ò�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����⻯��(NaBH4)��������ԭ�������Ϸ��ݼ������ڴ�����������ˮ��Ӧ��ȡ�������۹�����ͼ��ʾ������˵������ȷ����
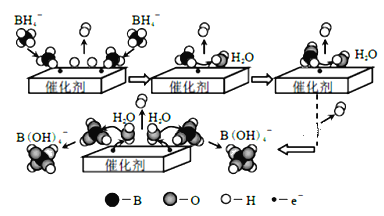
A.NaBH4����Ԫ�صĻ��ϼ�Ϊ+1��
B.����D2O����H2O����Ӧ�����ɵ������к���H2��HD��D2
C.ͨ�����ƴ����������ͱ���������Կ��������IJ�������
D.NaBH4 ��ˮ��Ӧ�����ӷ���ʽΪ��BH4��+4H2O=B(OH)4��+4H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.�����ȼ����Ϊ890.3kJ/mol�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)+2O2(g)=CO2(g)+2H2O(g)H=-890.3kJ/mol
B.ͬ�ֽ�����Ϊԭ��ص���������Ϊ���ص�������ʴ�ø���
C.��ϡ���������ǹ��Ⱥ����Һ�еμ�������Һ��ˮԡ���ȣ�δ������������˵������û��ˮ��
D.![]() �Ķ��ȴ���������
�Ķ��ȴ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɺ����ˮ��ȡ����ص�һ�ֹ������£�

����KI(aq)��ʱ�����¶���ˮ�����ӻ�ΪKw��1.0��10��13��Ksp[Fe(OH)2]��9.0��10��15��Ϊ����0.9 mol��L��1 FeI2��Һ��Fe2+ˮ�����ɽ�״������I-����ʼ����K2CO3���뱣����Һ��pH������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ��������ȷ����
A.��˹����ʵ�����������غ㶨�ɵ�����
B.�ڼ��������½��еķ�Ӧ��һ�������ȷ�Ӧ
C.��3O2(g)=2O3(g)H=+284.2kJ/mol����֪O2��O3�ȶ�
D.��֪��H2(g)��ȼ������H=-285.8kJ/mol����2H2O(l)=2H2(g)+O2(g) H=+285.8kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��Ǧ�����ǵ��͵Ŀɳ��͵�أ���ش���������(�������⡢����������ԭ)���ŵ�ʱ�������ĵ缫��Ӧʽ��____________�����Һ��H2SO4��Ũ�Ƚ�_______�����С�����䣩�������·ͨ��0.5 mol����ʱ�������ϸ��������������__________g��
��2���ü״�ȼ�ϵ�ص��AgNO3��Һ����ͼ��ʾ���ش��������⣺
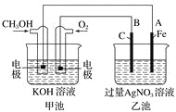
�ټ׳���________װ�ã�ͨ��CH3OH�ĵ缫������______��
��д��ͨ��O2�ĵ缫�ĵ缫��Ӧʽ��________________��
��A�缫�ĵ缫��ӦʽΪ_________________________��
�ܵ��ҳ���A(Fe)������������2.70 gʱ���׳�������������O2_____mL(��״����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���в���ȷ����
A. �����顢�����顢�����黥Ϊͬ���칹��
B. 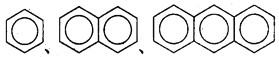 ��Ϊͬϵ��
��Ϊͬϵ��
C. ������ϩ����������ԭ�Ӷ�����ͬһƽ��
D. �����ᣨ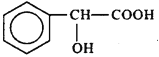 �����ڼ����������ǻ�ֱ�����ڱ����ϵ�ͬ���칹�干��13��
�����ڼ����������ǻ�ֱ�����ڱ����ϵ�ͬ���칹�干��13��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ֱ��dz�����һԪ�����ǿ�ᣮ
��1��������ˮ��Һ�еĵ��뷽��ʽΪ_________________��
��2����ѧ�����������ȣ�AG����ʾ��Һ����Եĸ���涨��AG=lg![]() ��pH=3�Ĵ�����Һ��AG=_________________��
��pH=3�Ĵ�����Һ��AG=_________________��

��3����0.1molL��1NaOH��Һ�ֱ�ζ������Ϊ20.00mLŨ�Ⱦ�Ϊ0.1molL��1������ʹ�����Һ���õ��ζ���������ҺpH�����NaOH��Һ������仯�������ζ����ߡ�
��������������________________������I������II������
��V1��V2�Ĺ�ϵ��V1_________V2��������������=��������������
��M���Ӧ����Һ�У������ӵ����ʵ���Ũ���ɴ�С��˳����________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ�������ƴ������ᡣ��CuO��Cu�����ս�Ҳ����ȡCu2O����֪��Ӧ��
��2Cu(s) + O2(g) = 2CuO(s) ��H = 314 kJ/mol
��2Cu2O(s) + O2(g) = 4CuO(s) ��H = 292 kJ/mol
��ӦCuO(s) ��Cu(s) ��Ӧ����Cu2O(s) ���Ȼ�ѧ����ʽ�ǣ� ��
A.CuO(s) + Cu(s) = Cu2O(s) ��H = 22 kJ/mol
B.CuO(s) + Cu(s) = Cu2O(s) ��H = +22 kJ/mol
C.CuO(s) + Cu(s) = Cu2O(s) ��H = 11 kJ/mol
D.CuO(s) + Cu(s) = Cu2O(s) ��H = +11 kJ/mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com