
(12分)已知反应2HI(g)  H2(g) +I2(g)在T℃下的平衡常数为0.01。T℃时,在容积为2L的密闭容器中加入HI ,反应到某时刻测得各组分的浓度如下:
H2(g) +I2(g)在T℃下的平衡常数为0.01。T℃时,在容积为2L的密闭容器中加入HI ,反应到某时刻测得各组分的浓度如下:
物质 | HI | H2 | I2 |
浓度/(mol·L-1) | 0.40 | 0.60 | 0.60 |
请计算回答下列问题(写出计算过程,否则不得分):
(1)起始加入HI的物质的量 mol。
(2)达到平衡后HI的物质的量浓度 mol·L-1(请保留三位有效数字)。
(3)T℃时,在另一个体积一定的密闭容器中,将I2(g)与H2(g) 置于其中发生上述反应,若达到平衡时H2(g)与I2(g)的体积比为1∶4,计算平衡时HI的体积分数为 ,以及开始时H2(g)与I2(g)的体积比为 。
21.(12分)(1)3.2mol(3分) (2)1.33 mol/L或1.34mol/L(3分)
(3)4/5或80%(3分) 11:14(3分)
【解析】
试题分析:(1)利用三段式,2HI(g) H2(g)+ I2(g)
H2(g)+ I2(g)
开始浓度 1.6mol/L 0 0
转化浓度 1.2mol/L 0.60mol/L 0.60mol/L
某时刻浓度 0.40mol/L 0.60mol/L 0.60mol/L
平衡浓度 1.6-2x x x 起始加入HI的物质的量为1.6X2=3.2mol
(2)根据K=x2/(1.6-2x)2=0.01 解得 x=2/15达到平衡后HI的物质的量浓度(1.6-4/15)÷2=1.33 mol/L;
(3)利用三段式,
2HI(g) H2(g)+ I2(g)
H2(g)+ I2(g)
开始浓度 0 a b
转化浓度 2x x x
平衡浓度 2x a-x b-x 解得(a-x)/(b-x)=1/4 (a-x)(b-x)/4x2=0.01,
解得a=11,b=14,平衡时HI的体积分数为80%,开始时H2(g)与I2(g)的体积比为11:14
考点:考查化学平衡的有关计算。


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
| A、二氧化氮和二氧化碳 | B、一氧化碳和二氧化碳 | C、二氧化硫和二氧化碳 | D、二氧化硫和二氧化氮 |
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.向氯化铝溶液通入过量的氨气:Al3+ +4OH- AlO2- +2H2O
AlO2- +2H2O
B.过量氯气通人溴化亚铁溶液中2Cl2 +2Fe2+ +2Br- 4Cl-+2Fe3++ Br2
4Cl-+2Fe3++ Br2
C.次氯酸钠与浓盐酸反应产生Cl2:ClO-+Cl—+H2O=Cl2↑+2OH—
D.NaHCO3溶液与少量Ba(OH)2溶液反应:Ba2++2OH-+2HCO3-=BaCO3↓+CO32—+2H2O
查看答案和解析>>
科目:高中化学 来源:2015届江苏省、常州一中、沭阳中学高三联合调研化学试卷(解析版) 题型:选择题
普伐他汀是一种调节血脂的药物,其结构简式如下图所示(未表示出其空间构型)。下列关于普伐他汀的性质描述正确的是

A.能与FeCl3溶液发生显色反应
B.能使酸性KMnO4溶液褪色
C.能发生加成、取代、消去反应
D.1mol该物质最多可与1molNaOH反应
查看答案和解析>>
科目:高中化学 来源:2015届江苏省、常州一中、沭阳中学高三联合调研化学试卷(解析版) 题型:选择题
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3+ + 2I- Fe2+ + I2
Fe2+ + I2
C.和Ba(OH)2溶液反应的离子方程式:Fe3+ + SO42- + Ba2+ + 3OH- Fe(OH)3↓+ BaSO4↓
Fe(OH)3↓+ BaSO4↓
D.1L0.1mol/该溶液和足量的Zn充分反应,生成11.2gFe
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(解析版) 题型:填空题
(16分)化学反应原理对化学反应的研究具有指导意义。
(1)机动车废气排放已成为城市大气污染的重要来源。
①气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
②汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g) ΔH>0,该设想能否实现? (选填“能”或“不能”),依据是 。
(2)氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有1/3与水反应。该反应的离子方程式为 ,在上述平衡体系中加入少量NaOH固体,溶液中Cl—浓度 (选填“增大”、“减小”或“不变”)。
(3)一定条件下,Fe3+和I—在水溶液中的反应是2I—+2Fe3+ I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向 (选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案 。
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向 (选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(解析版) 题型:选择题
在一定温度下,容积不变的密闭容器中发生反应:C(s)+H2O(g)  CO(g)+H2(g),下列叙述不能认定该可逆反应已经达到平衡状态的是
CO(g)+H2(g),下列叙述不能认定该可逆反应已经达到平衡状态的是
A.混合气体压强不再发生变化
B.混合气体质量不再发生变化
C.反应中CO与H2的物质的量之比为1︰1
D.生成nmol CO的同时生成nmol H2O
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三质量调研化学试卷(解析版) 题型:选择题
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是

A.线段BC代表Fe3+ 物质的量的变化情况
B.原混合溶液中n(FeBr2)=6mol
C.当通入Cl2 2mol时,溶液中已发生的离子反应可表示为:
2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.原溶液中n(Fe2+): n(I-): n(Br-)=2:1:3
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:填空题
(14分)以化合物A为原料合成化合物M的线路如下图所示:
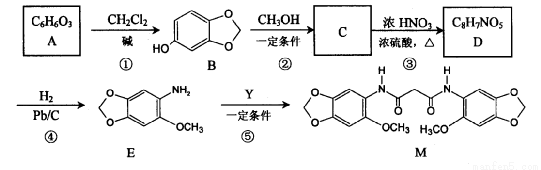
已知: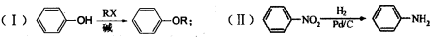
(1)写出下列反应的反应类型:反应①: ;反应④: 。
(2)写出化合物B中含氧官能团的名称: 和 。
(3)反应⑤中除生成M外,还有CH3OH生成。请写出物质A和Y的结构简式:
A Y 。
(4)写出同时满足下列条件的B的两种同分异构体的结构简式: 和 。
I.分子中含有苯环结构:
II.分子中有4种不同化学环境的氢:
Ⅲ.既能与FeCI3溶液发生显色反应,也能发生银镜反应
(5)反应②和反应③的次序不能颠倒,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com