
【题目】由锌片、铜片和200 mL稀H2SO4组成的原电池如图所示。
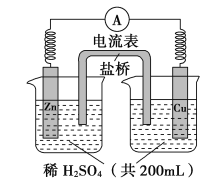
(1)原电池的负极反应是______________________,
正极反应是__________________________。
(2)电流的方向是_____________。
(3)一段时间后,当在铜片上放出1.68 L(标准状况下)气体时,H2SO4恰好消耗一半。则产生这些气体的同时,共消耗________g锌,有____________个电子通过了导线,原硫酸的物质的量浓度是_____________(设溶液体积不变)。
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下,相同质量的①O2 ②CH4 ③N2 ④Cl2,体积由大到小排列正确的是 ( )
A.①>②>③>④ B.④>①>③>② C.②>③>①>④ D.②>①>④>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
A. 石油裂解和油脂皂化都是由高分子生成小分子的过程
B. 丙烯分子中所有原子不可能在同一平面上
C. (CH3)3CCH2CH3的一氯代物有3种
D. 甲苯的硝化、乙酸乙酯的水解均可看作取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 在一定条件,苯与浓硝酸反应生成硝基苯的反应类型是取代反应
B. 天然气、沼气、“可燃冰”的主要成分均为甲烷
C. 乙烯和乙炔都能使溴水褪色,其褪色原理相同
D. 相同质量的乙炔与苯分别在足量的氧气中完全燃烧,产生CO2的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2 L
B.在常温常压下,11.2 L Cl2含有的分子数为0.5NA
C.25℃,1.01×105Pa,64 g SO2中含有的原子数为3NA
D.标准状况下,11.2 L H2O含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。
(2)碳在形成化合物时,其键型以共价键为主,原因是 。
(3)C2H2 分子中,共价键的类型有 ,C 原子的杂化轨道类型是 ,写出两个与C2H2具有相同空间构型含碳无机物分子的分子式 。
( 4 )CO 能与金属Fe、Ni分别形成Fe(CO)5、Ni(CO)4,Fe(CO)5中Fe元素的原子核外电子排布为 ,Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂推测Ni(CO)4是 晶体。
(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
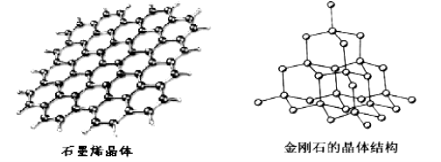
①石墨烯晶体中,每个C 原子连接 个六元环,每个六元环占有 个C 原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接 个六元环,六元环中最多有 个C原子在同一平面。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程能得到常用的单质、聚铁(碱式硫酸铁的聚合物)、铁红(Fe2O3)和绿矾(FeSO4·7H2O)。
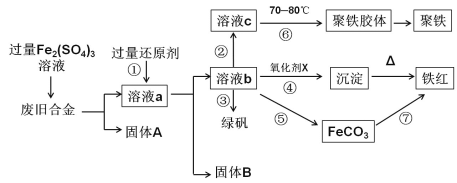
(1)加入过量Fe2(SO4)3溶液过程中与较活泼的金属反应的离子方程式: 。
(2)①中过量的还原剂应是 ,固体B是 。
(3)向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为
(4)②中加入H2O2,并调节pH值得到溶液c,在⑥中,将溶液c控制到70~80 ℃的目的是 。
(5)在③中,蒸发浓缩需要的硅酸盐仪器除酒精灯外,还有 。
(6)在④中的氧化剂X是 。
(7)在⑤中,向溶液b加入了NH4HCO3溶液,得到FeCO3沉淀,写出其离子反应方程式: 。
(8)在⑦中,写出FeCO3煅烧的化学反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.化学反应的焓变与反应的途径有关
B.室温下,稀释0.1mol·L-1CH3COOH溶液,溶液的导电能力减弱
C.常温常压下,22.4L Cl2中含有的分子数为6.02×1023个
D.等质量的铜按a、b两种途径完全转化为Cu(NO3)2,途径a、b消耗的硝酸一样多
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com