
| A. | 建造三峡大坝使用了大量水泥,水泥属于硅酸盐材料 | |
| B. | 人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2 | |
| C. | 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 | |
| D. | 金属冶炼的本质是金属阳离子得到电子变成金属原子 |
分析 A.水泥是传统的无机非金属材料,主要成分为硅酸盐;
B、人造刚玉的主要成分是氧化铝;
C.硅元素是两性元素位于金属和非金属的分界线处;
D.金属冶炼的本质是金属阳离子得到电子变成金属原子,金属的活泼性不同,冶炼方法不同.
解答 解:A.水泥是传统的无机非金属材料,主要成分为硅酸盐,故A正确;
B、人造刚玉的主要成分是氧化铝,不是二氧化硅,故B错误;
C.硅元素是两性元素,表现金属和非金属的性质,周期表中处于金属与非金属的交界位置,故C正确;
D.冶炼金属时,金属元素以化合态存在,要冶炼呈单质,金属阳离子得到电子变成金属原子,故D正确;
故选B.
点评 本题考查了硅及其硅酸盐应用,金属冶炼等知识点,掌握基础是解题关键,题目难不大.


科目:高中化学 来源: 题型:选择题
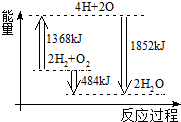
| A. | 拆开2 mol H2(g)和1 mol O2(g)中的化学键成为H、O原子,共放出1368 kJ能量 | |
| B. | 由H、O原子形成2 mol H2O(g),共吸收1852 kJ能量 | |
| C. | 2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),共吸收484 kJ能量 | |
| D. | 2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),共放出484 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s22p63s23p64s1 | B. | 1s22s22p63s23p63d104s1 | ||
| C. | 1s22s22p63s23p63d104s24p5 | D. | 1s22s22p63s23p63d54s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL | B. | 200mL | C. | 450mL | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com