
| A£® | ¢Ł¢Ū | B£® | ¢Ś¢Ū | C£® | ¢Ł¢Ü | D£® | ¢Ś¢Ü |
·ÖĪö ·“Ó¦2sŗó²āµĆCµÄÅضČĪŖ0.6mol/L£¬CµÄĪļÖŹµÄĮæ=0.6mol/L”Į2L=1.2mol£¬Ōņ£ŗ
2A£Øg£©+B£Øg£©?2C£Øg£©
ĘšŹ¼Įæ£Ømol£©£ŗ4 2 0
±ä»ÆĮæ£Ømol£©£ŗ1.2 0.6 1.2
2sÄ©Įæ£Ømol£©£ŗ2.8 1.4 1.2
¢Łøł¾Żv=$\frac{”÷c}{”÷t}$¼ĘĖćv£ØA£©£»
¢Śøł¾Ż×Ŗ»ÆĀŹ=$\frac{ŅŃ×Ŗ»ÆµÄĪļÖŹµÄĮæ}{ĘšŹ¼µÄĪļÖŹµÄĮæ}$”Į100%¼ĘĖć£»
¢Ūøł¾Żv=$\frac{”÷c}{”÷t}$¼ĘĖćv£ØB£©£»
¢Üøł¾Żc=$\frac{n}{V}$¼ĘĖć£®
½ā“š ½ā£ŗ·“Ó¦2sŗó²āµĆCµÄÅضČĪŖ0.6mol/L£¬CµÄĪļÖŹµÄĮæ=0.6mol/L”Į2L=1.2mol£¬Ōņ£ŗ
2A£Øg£©+B£Øg£©?2C£Øg£©
ĘšŹ¼Įæ£Ømol£©£ŗ4 2 0
±ä»ÆĮæ£Ømol£©£ŗ1.2 0.6 1.2
2sÄ©Įæ£Ømol£©£ŗ2.8 1.4 1.2
¢Łv£ØA£©=$\frac{\frac{1.2mol}{2L}}{2s}$=0.3mol/£ØL•s£©£¬¹Ź¢ŁÕżČ·£»
¢ŚAµÄ×Ŗ»ÆĀŹĪŖ$\frac{1.2}{4}$”Į100%=30%£¬¹Ź¢Ś“ķĪó£»
¢Ūv£ØB£©=$\frac{\frac{0.6mol}{2L}}{2s}$=0.15l/£ØL•s£©£¬¹Ź¢Ū“ķĪó£»
¢Ü2sŹ±BµÄÅضČĪŖ$\frac{1.4mol}{2L}$=0.7mol/L£¬¹Ź¢ÜÕżČ·£¬
¹ŹŃ”£ŗC£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗā¼ĘĖć”¢·“Ó¦ĖŁĀŹ¼ĘĖć£¬±Č½Ļ»ł“”£¬×¢ŅāÕĘĪÕČż¶ĪŹ½½āĢā·ØŌŚ»ÆŃ§Ę½ŗā¼ĘĖćÖŠÓ¦ÓĆ£¬ÓŠĄūÓŚ»ł“”ÖŖŹ¶µÄ¹®¹Ģ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 °“ŅŖĒ󊓳öĻĀĮŠ»Æѧ·½³ĢŹ½£ŗ
°“ŅŖĒ󊓳öĻĀĮŠ»Æѧ·½³ĢŹ½£ŗ £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
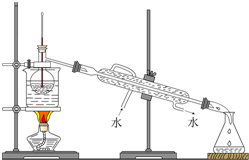
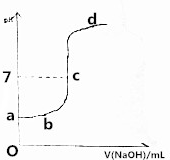 ŌŚŃŠ¾æČõµē½āÖŹµÄµēĄė”¢ŃĪĄąµÄĖ®½āŗĶČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”±Č½ĻÖŠ£¬Ä³Ź¦Éś¹²Ķ¬×öĮĖÕāŃłŅ»øöŹµŃé£ŗ³£ĪĀĻĀ£¬Ļņ20.0mL£¬0.1mol/LCH3COOHČÜŅŗÖŠÖšµĪ¼ÓČė0.01mol/LµÄNaOHČÜŅŗ£¬²¢ŌŚµĪ¼Ó¹ż³ĢÖŠ²»¶ĻÓĆpH¼Ę²āĮæ»ģŗĻČÜŅŗµÄpH£¬»ę³öpH-V£ØNaOH£©Ķ¼Ļó£¬ČēĶ¼ĖłŹ¾£®Ēė·ÖĪö£ŗ
ŌŚŃŠ¾æČõµē½āÖŹµÄµēĄė”¢ŃĪĄąµÄĖ®½āŗĶČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”±Č½ĻÖŠ£¬Ä³Ź¦Éś¹²Ķ¬×öĮĖÕāŃłŅ»øöŹµŃé£ŗ³£ĪĀĻĀ£¬Ļņ20.0mL£¬0.1mol/LCH3COOHČÜŅŗÖŠÖšµĪ¼ÓČė0.01mol/LµÄNaOHČÜŅŗ£¬²¢ŌŚµĪ¼Ó¹ż³ĢÖŠ²»¶ĻÓĆpH¼Ę²āĮæ»ģŗĻČÜŅŗµÄpH£¬»ę³öpH-V£ØNaOH£©Ķ¼Ļó£¬ČēĶ¼ĖłŹ¾£®Ēė·ÖĪö£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
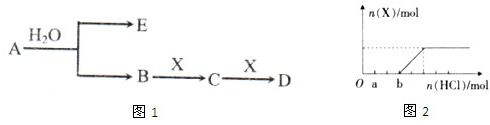
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ”°µĪĖ®ŹÆ“©”¢Éž¾āľ¶Ļ”±Ņ»¶Ø²»Éę¼°»Æѧ±ä»Æ | |
| B£® | Ć÷·Æ¾»Ė®µÄŌĄķŗĶ”°84”±Ļū¶¾ŅŗĻū¶¾µÄŌĄķ²»ĻąĶ¬ | |
| C£® | ³ä·ÖæŖ·¢ĄūÓĆĢģČ»ĻĖĪ¬£¬Ķ£Ö¹Ź¹ÓĆø÷ÖÖ»ÆѧŗĻ³É²ÄĮĻ | |
| D£® | Ź³Ę·°ü×°“üÖŠ³£·ÅČėŠ”“üµÄÉśŹÆ»Ņ£¬ÄæµÄŹĒ·ĄÖ¹Ź³Ę·Ńõ»Æ±äÖŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ½«40 g NaOHČÜÓŚ1 LĖ®ĖłµĆµÄČÜŅŗ | |
| B£® | ½«22.4 L HClČÜÓŚĖ®Åä³É1 LČÜŅŗ | |
| C£® | 1 Lŗ¬2 mol K+µÄK2SO4ČÜŅŗ | |
| D£® | ½«0.5 mol•L-1µÄNaNO3ČÜŅŗ100 mL¼ÓČČÕō·¢µō50 g Ė®ŗóµÄČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼ÓČėNH4HSO4¹ĢĢ壬v£ØH2£©²»±ä | B£® | ¼ÓČėÉŁĮæĮņĖįÄĘČÜŅŗ£¬v£ØH2£©¼õŠ” | ||
| C£® | ¼ÓČėCH3COONa¹ĢĢ壬v£ØH2£©²»±ä | D£® | µĪ¼ÓÉŁĮæCuSO4ČÜŅŗ£¬v£ØH2£©¼õŠ” |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com