
【题目】已知化学反应①:Fe(s)+CO2(g) ![]() FeO(s)+CO(g),其平衡常数为K1;化 反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化 反应②:Fe(s)+H2O(g) ![]() FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1173 K | 2.15 | 1.67 |
请填空:(1)通过表格中的数值可以推断:K1随温度的升高而____________,(填增大,减小,不变),所以反应①是____________(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g) ![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的数表达式:K3=__________,根据数据可知反应③是吸热反应。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数表达式:K3=__________,根据数据可知反应③是吸热反应。
(3)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有___(填写字母序号,下同)。
A.增大压强(压缩容器体积)
B.体积不变时充入稀有气体
C.升高温度
D.使用合适的催化剂
(4)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件可能是_____________ 、____________。
②图乙中t2时刻发生改变的条件可能是__________。
A.升高温度 B.降低温度 C.加入催化剂 D.增大压强 E.减小压强 F.充入CO2 G.分离出部分CO
【答案】增大 吸热 c(CO) c(H2O)/c(CO2) c(H2) C C D B
【解析】
(1) 由表中数据可知,温度升高,①的平衡常数增大,说明平衡向正反应方向移动,则正反应吸热;综上所述,本题答案是:增大;吸热。
(2) 平衡常数为反应达平衡后生成物浓度的幂之积与反应物浓度的幂之积的比值;反应③可逆反应CO2(g)+H2(g) ![]() CO(g)+H2O(g),该反应的平衡常数K3=c(CO)c(H2O)/c(CO2) c(H2);综上所述,本题答案是:c(CO)c(H2O)/c(CO2)c(H2)。
CO(g)+H2O(g),该反应的平衡常数K3=c(CO)c(H2O)/c(CO2) c(H2);综上所述,本题答案是:c(CO)c(H2O)/c(CO2)c(H2)。
(3)根据①Fe(s)+CO2(g) ![]() FeO(s)+CO(g),其平衡常数为K1;②Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;②Fe(s)+H2O(g) ![]() FeO(s)+H2(g),其平衡常数为K2;根据盖斯定律:①-②得:CO2(g)+H2(g)
FeO(s)+H2(g),其平衡常数为K2;根据盖斯定律:①-②得:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其平衡常数为K3;由于K3= K1/ K2,由图表可知,温度升高K1增大,K2减小,所以K3增大,即温度升高,平衡向正反应方向移动,升高温度平衡吸热方向移动,反应③为吸热反应;反应③是一个反应前后气体体积不变的吸热反应,压强、催化剂对化学平衡移动无影响,升高温度都能使平衡向正反应方向移动;综上所述,本题选C。
CO(g)+H2O(g),其平衡常数为K3;由于K3= K1/ K2,由图表可知,温度升高K1增大,K2减小,所以K3增大,即温度升高,平衡向正反应方向移动,升高温度平衡吸热方向移动,反应③为吸热反应;反应③是一个反应前后气体体积不变的吸热反应,压强、催化剂对化学平衡移动无影响,升高温度都能使平衡向正反应方向移动;综上所述,本题选C。
(4) ①该反应是一个反应前后气体体积不变的吸热反应,图甲中t2时刻改变条件,正逆反应速率都增大但平衡不移动,改变的条件为增大压强或加入催化剂;综上所述,本题答案是:C D。
②图乙中t2时刻发生改变的条件,平衡向逆反应方向移动,二氧化碳浓度增大,一氧化碳浓度减小,可以采用降低温度或增大水蒸气的浓度或减小氢气的浓度,选项B符合题意;综上所述,本题选B。


科目:高中化学 来源: 题型:
【题目】Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:
2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据____________。
(2)用离子方程式表示除去固体产物中Al2O3的原理________。
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理____________。
Ⅱ.磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:

请回答:
(1)A的组成元素为_________(用元素符号表示),化学式为______。
(2)溶液C可溶解铜片,例举该反应的一个实际应用____________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为____。写出该反应的离子方程式__________。
(4)写出F→G反应的化学方程式_____________。设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验方案能达到实验目的的是( )
编号 | A | B | C | D |
实验方案 |
|
|
|
|
实验目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.含有共价键的化合物可能是共价化合物
B.在共价化合物中可能存在离子键
C.含有离子键的化合物中一定是没有共价键
D.难失电子的原子,获得电子的能力一定强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面提到的问题中,与盐的水解有关的是( )
①明矾和FeCl3可作净水剂
②为保存FeCl3溶液,要在溶液中加少量盐酸
③实验室配制AlCl3溶液时,应先把它溶解在盐酸中,而后加水稀释
④NH4Cl溶液可作焊接中的除锈剂
⑤实验室盛放Na2SiO3溶液的试剂瓶应用橡皮塞,而不能用玻璃塞
⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
⑦在NH4Cl或AlCl3溶液中加入金属镁会生成氢气
⑧草木灰与铵态氮肥不能混合施用
⑨加热蒸干AlCl3溶液得到Al(OH)3固体.
A. ①④⑦ B. ②⑤⑧ C. ③⑥⑨ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到的滤液用 NaHCO3溶液处理,测得溶液的pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下图所示。下列有关说法错误的是
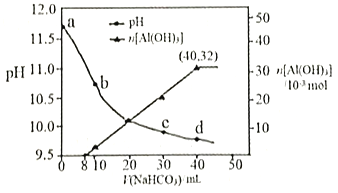
A. a点溶液中存在:c(Na+)+c(H+)=c(AlO2-)+c(OH-)
B. 水的电离程度:a点小于c点
C. 原 NaHCO3溶液中c(H2CO3)+c(HCO3-)+c(CO32-)=0.8mol·L-1
D. 生成沉淀的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A+3B=2C+D在某段时间内以A的浓度变化表示的化学反应速率为1 mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为
A. 0.5mol·L-1·min-1B. 1mol·L-1·min-1
C. 2mol·L-1·min-1D. 3mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大。
CH3COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大。
B. 25 ℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O![]() H++OH-逆向移动,c(H+)降低
H++OH-逆向移动,c(H+)降低
C. 取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大
D. 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3- )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com