
分析 ①CH3CH3和C2H6分别为乙烷的结构简式和分子式,是一种物质;
②CH2=CH2和CH3CH=CH2,结构相似,分子组成上相差1个CH2原子团,属于同系物;
③CH3CH2C≡CH和CH3C≡CCH3分子式相同,官能团的位置不同,属于同分异构体;
④O2和O3均属于氧元素的不同种单质,互为同素异形体;
⑤${\;}_{6}^{12}$C和${\;}_{6}^{13}$C均是碳元素的不同种原子,互为同位素,据此解答即可.
解答 解:②中乙烯(CH2=CH2)和丙烯(CH3CH=CH2),结构相似,分子组成上相差1个CH2原子团,属于同系物;
③CH3CH2C≡CH和CH3C≡CCH3分子式相同,官能团的位置不同,属于同分异构体;
④O2和O3均属于氧元素的不同种单质,互为同素异形体;
⑤${\;}_{6}^{12}$C和${\;}_{6}^{13}$C均是碳元素的不同种原子,互为同位素,故答案为:②;③;④;⑤.
点评 本题主要考查的是同系物、同分异构体、同位素的概念,属于常考题类型之一,注意概念间的区别,难度不大.


科目:高中化学 来源: 题型:解答题
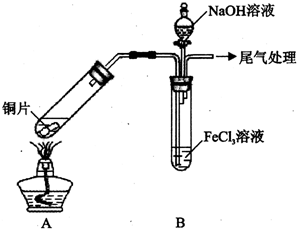 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).| 步骤② | 往5mL 1mol•LFeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热在较短时间内溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.短时间内发现溶液颜色变成浅绿色. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,11.2L的甲烷气体含有甲烷分子数为0.5 NA | |
| B. | 14g乙烯和丙烯的混合物中总原子数为3 NA | |
| C. | 标准状况下,22.4 L氯仿中含有的氯原子数目为3 NA | |
| D. | 17.6 g丙烷中所含的极性共价键为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ①③④ | C. | ②④⑥ | D. | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加 | |
| B. | 化学反应速率为0.8 mol/(L•s)是指1s时某物质的浓度为0.8mol/L | |
| C. | 根据化学反应速率的大小可以知道化学反应的相对快慢 | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象越明显 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ②④⑥ | C. | ①②③⑤ | D. | ①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com