
可在有机物中引入羟基的反应类型是( )
①取代 ②加成 ③消去 ④酯化 ⑤还原
A.①②③ B.①②⑤
C.①④⑤ D.②③⑤
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
有机物M的结构简式如图所示。
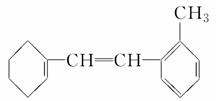
(1)有机物M的苯环上的一氯代物有________种。
(2)1 mol M与足量溴水混合,消耗Br2的物质的量为________mol。
(3)1 mol M与足量H2加成,消耗H2________ mol。
(4)下列有关M的说法中不正确的是________。
A.在催化剂的作用下,M可与液溴发生取代反应
B.M使溴水褪色的原理与乙烯使溴水褪色的原理相同
C.M能使酸性KMnO4溶液褪色
D.M和甲苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
向NaBr、NaI、Na2SO3的混合液中,通入足量的氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )
A.NaCl、Na2SO4 B.NaCl、NaBr、Na2SO4 C.NaCl、Na2SO4、I2 D.NaCl、NaI、Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按右图所示步骤分开五种离子,则溶液①②③④分别是( ) 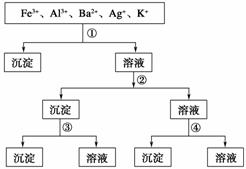
A.①NaCl、②NaOH、③NH3·H2O、④H2SO4
B.①H2SO4、②NaOH、③NH3·H2O、④NaCl
C.①H2SO4、②NH3·H2O、③NaOH、④NaCl
D.①NaCl、②NH3·H2O、③NaOH、④H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
铝镁合金已成为轮船制造、化工生产等行业的重要材料。某研究性学习小组的三位同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白。
探究一
实验方案:铝镁合金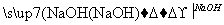 测定剩余固体质量。实验中发生反应的化学方程式是____________________________________________________________________________________________________________。
测定剩余固体质量。实验中发生反应的化学方程式是____________________________________________________________________________________________________________。
实验步骤:
(1)称取5.4 g铝镁合金粉末样品,投入V mL 2.0 mol/L NaOH溶液中,充分反应。NaOH溶液的体积V≥________。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将________(填“偏高”或“偏低”)。
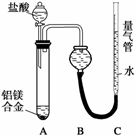
探究二
实验方案:铝镁合金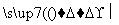 测定生成气体的体积(实验装置如图所示),问题讨论:
测定生成气体的体积(实验装置如图所示),问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是________(填“需要”或“不需要”)。
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
①__________,②__________。
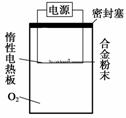
探究三
实验方案:称量x g铝镁合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。
问题讨论:
(1)欲计算Mg的质量分数,该实验中还需测定的数据是__________________。
(2)若用空气代替O2进行实验,对测定结果是否有影响?________(填“是”或“否”)。
实验拓展
参照探究一、探究二实验方案,请你另设计一个实验方案,测定该铝镁合金中镁的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:与 结构相似的醇不能被氧化成对应的醛或羧酸。“智能型”高分子在生物工程中有广泛的应用前景。PMAA就是一种“智能型”高分子材料,可用于生物制药中大分子和小分子的分离。下面是以物质A为起始反应物合成PMAA的路线:
结构相似的醇不能被氧化成对应的醛或羧酸。“智能型”高分子在生物工程中有广泛的应用前景。PMAA就是一种“智能型”高分子材料,可用于生物制药中大分子和小分子的分离。下面是以物质A为起始反应物合成PMAA的路线:
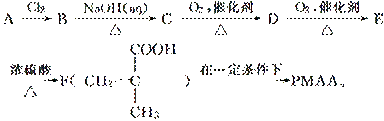
请填写下列空白:
(1)A的结构简式为________________________________________________________。
(2)写出下列反应的化学方程式:
E→F:________________________________________________________________________;
F→PMAA:________________________________________________________________________。
(3)E在有浓硫酸加热的条件下,除了生成F外,还可能生成一种分子内有一个六元环的有机物G,G的结构简式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)请列举海水淡化的两种方法:________、________。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_______,
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_______。
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如下装置简图:
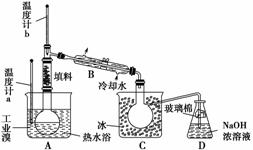
请你参与分析讨论:
①图中仪器B的名称是____________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?___________。
④C中液体颜色为________________。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,常用于水的消毒以及纺织高漂白。过氧化氢法生产亚氯酸钠的流程图如下
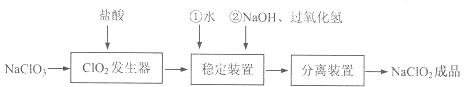
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O且NaClO2在碱性条件下稳定性较高。试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为
(2)在NaClO2稳定装置中,H2O2作 (选填序号)。
A.氧化剂 B.还原剂
C.既作氧化剂又作还原剂 D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是 (按实验后顺序填写操作代号)。
A.过滤 B.加热 C.分液 D.蒸馏 E.冷却
(4)经查阅资料知道:当pH≤2.0时,ClO-2能被I完全还原成Cl—;
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6。
欲测定成品中NaClO2的含量,现进行如下操作:

①步骤Ⅱ中发生反应的离子方程式是 ,
步骤Ⅲ中达到滴定终点时的现象是 。
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数 (用字母表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com