
| A.酚酞试液 | B.氯化钡溶液 | C.石蕊试液 | D.碳酸钠溶液 |
科目:高中化学 来源:不详 题型:单选题
| A.一定含有Fe元素 | B.一定含有Mg元素 |
| C.一定禽含有Cu元素 | D.一定含有Al元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加水溶解后,过滤分离 | B.加稀盐酸溶解后,过滤分离 |
| C.加NaOH溶液溶解后,过滤分离 | D.用酒精灯加热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.除去N2中的少量O2:通过灼热的CuO粉末,收集气体 |
| B.除去NaCl溶液中的少量NaBr:通入适量Cl2,过滤 |
| C.除去CO2中的少量HCl:通入饱和NaHCO3溶液,收集气体 |
| D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水;无水CaCl2固体 |
| B.饱和NaHCO3溶液;浓H2SO4 |
| C.浓H2SO4;饱和NaHCO3溶液 |
| D.饱和NaHCO3溶液;稀H2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 从海水中提取,以下是提取镁的过程中涉及到的几种物质常温下的溶度积常数,根据你所学的知识回答下面的几个问题:?
从海水中提取,以下是提取镁的过程中涉及到的几种物质常温下的溶度积常数,根据你所学的知识回答下面的几个问题:?| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
| 溶度积 | 2.8×10-9 | 6.8×10-6 | 5.5×10-6 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向某无色溶液加入氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,可得出结论:溶液中含NH4+ |
| B.用pH试纸测定某溶液的pH时,需将pH试纸放入溶液中,观察其颜色变化,跟标准比色卡比较 |
| C.向某无色试液加入Na2CO3溶液产生白色沉淀,可得出结论:试液中含Ca(OH)2 |
| D.向某无色溶液加入硝酸银溶液有白色沉淀产生,该溶液中一定有含Cl— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质 | 分子式 | 熔点℃ | 沸点℃ | 密度g?cm-3 | 水溶性 |
| A | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
| B | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
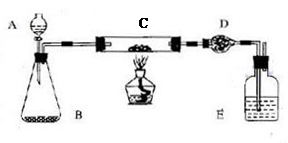
| 实 实验过程 | 实 实验现象 | 有 有关化学方程式 |
| 在C中加入样品标本W克,D中装入药品后并称量为m1克。连接好仪器后,检查气密性 | | |
| 打开A的活塞,慢慢滴加溶液。 | | |
| 对C进行加热。当C中药品充分反应后。关闭A的活塞。停止加热: | | |
| 冷却后,称量D的质量为m2克。 | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com