
| A. | 分液时,分液漏斗的上层液体应由上口到出 | |
| B. | 用重结晶法分离碳酸钠和碳酸氢钠两种固体 | |
| C. | 配置0.1000 mol•L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 | |
| D. | 检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
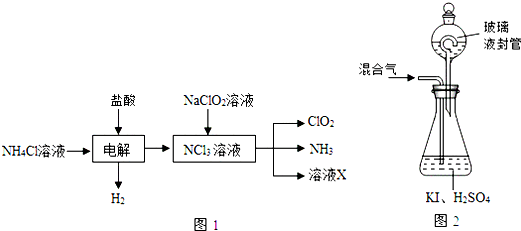
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
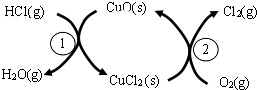 用O2将HCl转化为Cl2,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现,其中,反应①为:
用O2将HCl转化为Cl2,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现,其中,反应①为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
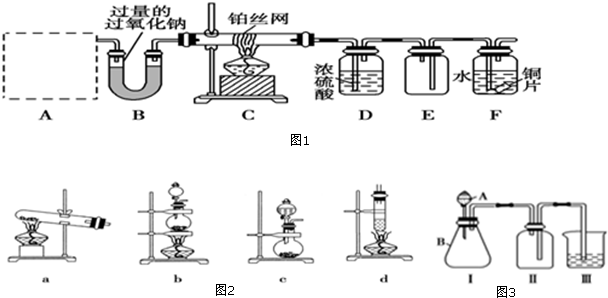
 某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.
某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com