
【题目】下列各情况,在其中Fe片腐蚀由快到慢的顺序是( )
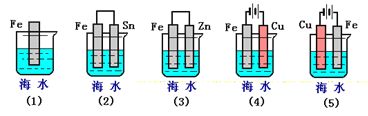
A. (5)(2)(1)(3)(4) B. (2)(5)(3)(4)(1)
C. (5)(3)(4)(1)(2) D. (1)(5)(3)(4)(2)
【答案】A
【解析】试题分析:根据图知,(2)(3)装置是原电池,在(2)中,金属铁做负极,(3)中金属铁作正极,做负极的腐蚀速率快,并且两个电极金属活泼性相差越大,负极金属腐蚀速率越快,正极被保护,并且原电池原理引起的腐蚀>化学腐蚀,所以(2)>(3),(4)(5)装置是电解池,(4)中金属铁为阴极,(5)中金属铁为阳极,阳极金属被腐蚀速率快,阴极被保护,即(5)>(4),根据电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀,并且原电池的正极金属腐蚀速率快于电解池的阴极金属腐蚀速率,所以铁腐蚀快慢顺序为:(5)>(2)>(1)>(3)>(4);故选A。


科目:高中化学 来源: 题型:
【题目】盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁,其反应:Fe2O3(s)+3CH4(g)2Fe(s)+3CO(g)+6H2(g) ΔH,在容积固定且均为1L的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中加入足量“纳米级”的金属铁,然后分别充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3(依次升高)且恒定不变,测得反应均进行到t min时CO的体积分数如图所示。下列说法正确的是( )
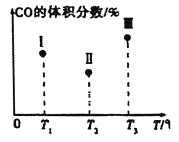
A.该反应的ΔH>0
B.容器Ⅲ中CO的体积分数可能为35%
C.容器中固体的质量不再改变,不能说明反应已达平衡状态
D.反应进行到tmin时,三个容器中一定达到平衡状态的是Ⅱ和Ⅲ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某城市主要空气污染物为![]() 、
、![]() 、
、![]() 科学实验小组为检测空气样本成分,用蒸馏水处理制成待测液,设计实验及所得实验现象如下:
科学实验小组为检测空气样本成分,用蒸馏水处理制成待测液,设计实验及所得实验现象如下:

下列判断不正确的是
A.上述实验中可用![]() 代替
代替![]() ,以证明待测试样中含
,以证明待测试样中含![]()
B.由实验![]() 可知待测试样中含有
可知待测试样中含有![]() 和
和![]()
C.焰色反应表明待测试样中含Na元素和K元素
D.该城市的污染来源主要是燃煤和机动车尾气排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2molA和2molB两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g),2min后反应达平衡状态,生成0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min后反应达平衡状态,生成0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于____;
(2)A的转化率为______;
(3)生成D的反应速率为___________;
(4)如果增大体系的压强,则平衡体系中C的质量分数_____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成共价化合物XH3、H2Z和HW;Y与氧元素可形成离子化合物Y2O和Y2O2。
(1)Y2Z的电子式是 ________
(2)实验室可用如图所示装置制备并收集XH3(缺少收集装置,夹持固定装置略去)。

①图中方框内应选用连接_____烧瓶收集XH3(填“A或B”)。
②实验室制法中大试管中的试剂一般选用(填写化学式)_________________。烧杯中溶液由无色变为红色,其原因是(用电离方程式表示):___________________________________
③XH3是工业上氧化法制硝酸的重要基础原料,制备过程中该物质发生的化学反应方程式为__________________________。
(3)磷在W2中燃烧可生成两种产物,其中一种产物甲,分子中各原子最外层不全是8电子结构,甲的化学式是_________。 XH3和HW两种化合物能反应生成离子化合物乙,n mol甲与n mol乙在一定条件下反应,生成4n mol HW和另一化合物,该化合物蒸气的密度是相同状况下氢气密度的174倍,其化学式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+![]() O2(g) ═ CO(g) + 2H2O(l) △H = -890.3kJmol-1
O2(g) ═ CO(g) + 2H2O(l) △H = -890.3kJmol-1
B.已知稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3kJ·mol-1,则稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出57.3kJ的热量
C.500℃下,将0.5mol I2(g)和0.5molH2(g)置于密闭的容器中充分反应生成HI(g),放热10kJ,其热化学方程式为:I2(g) + H2(g)![]() 2HI(g) △H = -20kJmol-1
2HI(g) △H = -20kJmol-1
D.已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1, 4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O2比O3稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛。图中表示两个常见的固氮反应:
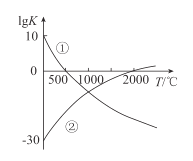
①![]()
②![]() 的平衡常数
的平衡常数![]() 与温度的关系,根据图中的数据判断下列说法正确的是( )
与温度的关系,根据图中的数据判断下列说法正确的是( )
A.反应②为放热反应
B.常温下,反应①的反应速率很大,而反应②的反应速率很小
C.升高温度,反应①的反应速率增大,反应②的反应速率减小
D.在常温下,利用反应①固氮和利用反应②固氮反应程度相差很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是( )
A.用惰性电极电解熔融氯化钠:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-=Mn2++Cl2↑+2H2O
C.向Na[Al(OH)4]溶液中通入过量CO2制Al(OH)3:[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-
D.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com